【桐晖药业】临床试验是对病人或健康志愿者进行的前瞻性干预研究,用来测试药物、设备或技术、以证实或揭示其有效性和安全性的试验。近年来,中国临床试验的数量一直在迅速增长,截至2017年12月31日,在美国国家医学图书馆官方网站(https://clinicaltrials.gov)上登记的临床试验总数为209200个,由中国开展的有8927个,占 4.27%。然而,从中国14亿(占全球20%)人口的角度考虑,中国在临床试验的参与方面仍有广阔的潜在空间。
在中国开展的这些临床试验中,32%由企业赞助,68%由其它基金赞助。企业赞助的临床试验有40%是针对药物或设备是否适用的III期临床试验。此类试验需要满足中国食品药品监督管理局(CFDA)的相关规定,在研究设计、伦理和质量控制方面都有较高要求,并由相关部门进行监督。
1998 年,CFDA出台了中国版《药品临床试验管理规范》(GCP),并于2016年进行了再次修订。根据此项管理规范,中国政府正在推动更高质量的临床试验,并对不同专业的临床试验有明确的规定。在这些规定中,最重要的是2015年7月22日CFDA颁发的临床试验数据自查报告及其补充条例,对1622个注册和正在开展的临床试验进行自检和审核。截至2016年6月底,业内撤回了1193项先前注册的临床试验,占全部自检试验中的83%。在中国,对药物和设备的注册试验的评估和批准主要由食品药品审核查验中心(CFDI)和CFDA旗下的药品评价中心(CDE)来完成,这两个中心检查之后,再由CFDA审批。
1、中国临床试验的现状
临床试验产生的数据需要分为三个阶段:数据采集、管理和分析(图1)。
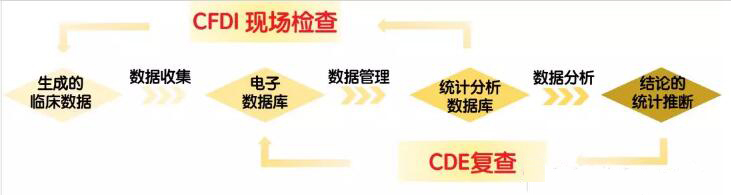
图1 临床试验从生成数据到结论的三个阶段
1.1数据采集
数据采集是统计分析的基础,也是CFDI检查数据准确性的重点和目标。依据法规,CFDI有权审查临床试验相关的文件、参考资料和法律文件等。审查对象包括临床试验机构、申请者机构或临床研究组织。2015 年7月22日,CFDA颁发了新版《中国食品药品监督管理局临床试验数据现场检查要点通报》,此版本含有更详细的检查要点。
在临床试验数据的现场检查方面,CFDA主要集中在准确性和完整性。基于“ALCOA+CCEA”(ALCOA是可溯源、清晰、同步、原始和准确的缩写;CCEA是完整、一致、持续和可用的缩写)原则来评价临床试验数据的质量。CFDI的药物临床试验数据检查期报告(2015年7月-2017年6月)显示,在313个试验的现场检查中,有4583个条目有缺陷;其中,临床试验过程的数据追踪、临床检查、实验室检查占这些缺陷的28.1%,违反了“ALCOA+CCEA”原则。
1.2 数据管理
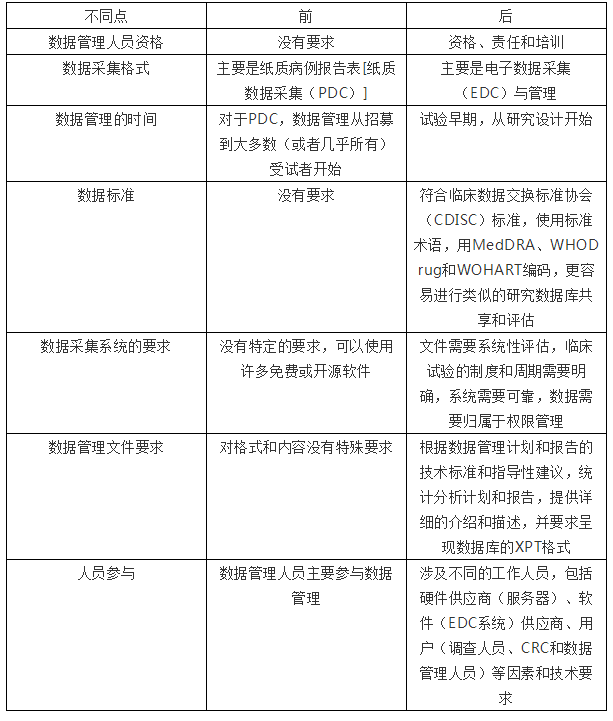
数据组织是数据处理和整合的一个步骤,使数据组织化、系统化,适合于统计分析,这是数据收集和分析之间的必要步骤。2016年7月29日,《临床试验数据管理工作技术指南》、《临床试验的电子数据采集技术指导原则》、《药物临床试验数据管理和统计分析的计划和报告指导原则》生效,这三个条例将数据管理要求提高到政府监管的水平。在新药临床试验过程中,申请方需要根据这些规定选择数据管理服务来管理和分析数据。在医疗器械和新的医疗技术的临床试验方面,这些新法规也可以遵循。表1显示了新法规前后数据管理的差异。
表1 新法规前后数据管理的差异
1.3数据分析
数据分析阶段是利用统计描述和推理来探索数据的内在模式和规律的过程。中国在2005年发布了《化学药物和生物制品临床试验的生物统计学技术指导原则》,在2016年发布了《新药临床试验的生物统计指导原则》,其中包含了详细的统计原则,强调了不同临床试验(I至III)的具体目的必须考虑,并且在同一临床试验中,一个临床试验的不同方面应该遵循相同的标准。
随着政府监管部门投入更多的资源和努力,数据管理和技术的更高标准和统计分析的最新需求将被应用于未来的临床试验中。在数据收集、管理和分析阶段,将实现“准确性、标准化和完整性”。
2、中国临床试验的挑战
2.1专业人才供给不足
GCP的视察和检阅是一项专门的工作,在中国由来自CFDI的检查人员进行。检查人员的资源、专业、稳定性和总数决定了工作的质量及其正当性、公平性和效率。目前在中国,现场部分主要是从外部聘请的专家完成的。虽然CFDI要求CRA强化培训,但对GCP执行程度的不一致,导致了不同CRA现场检查的差异。近年来上述情况有所改善,CFDI招聘人员不断增多,培训更加规范、一致。
受培训的生物统计师的数量和其培训质量不足。2010年的数据显示,中国只有25所大学提供流行病与统计博士学位,61所大学提供硕士学位。三分之一上述毕业生继续进行统计学培训,每年只有不到200位硕士和50位博士毕业。到2017年只多了一所提供流行病与统计专业硕士学位的大学,因此每年全国经过培训的生物统计师数量远不能满足临床研究的需求。另一方面,由于统计师主要毕业于医学院校的公共卫生系,这些数量不多的统计师的专业知识尤其在统计学的基础理论方面也疑有不足。
2.2国内发展的EDC系统仍不尽如人意
自从2016年实施《临床试验数据管理工作技术指南》、《临床试验的电子数据采集(EDC)技术指导原则》和《药物临床试验数据管理和统计分析的计划和报告指导原则》以来,更多的申请人和机构选择遵循国家级的数据管理制度。但是由于预算的限制,只有少数本地制药企业选择了国际EDC系统。虽然国内EDC系统越来越普及,但由于国内产品开发较晚,许多产品在应用过程中体验并不理想。目前,临床试验数据的EDC主要用于医疗机构,工作量较大,如果界面和用户体验不尽如人意,不仅会给研究者或临床研究助手带来不便,也会导致数据录入的不准确。
2.3 医院信息系统(HIS系统)无法作为临床试验的数据源
理论上,通过HIS系统收集数据便于其存储、组织、运输和检查。但是目前中国的大多数HIS系统是为了医疗服务而非为了临床试验所设计,因此存在着一定缺陷。中国HIS系统的患者隐私安全防护并不理想,这也导致一些侵犯性操作的发生。如一些研究者将自己账号提供给院外人员进行数据的浏览、写入和提取等。
3、中国临床试验面临的转变
在2017年中期,国际医学期刊编辑委员会(ICMJE)要求“共享数据”,并在2018年7月提交临床试验论文后,签署数据共享声明。预计将于2019年1月1日后进行临床试验,在网站上注册临床试验时要求提交数据共享计划。这一要求连同临床试验登记将逐渐被研究者接受和应用,这意味着未来需要更高的临床数据管理标准。
中国是世界上最大的发展中国家,拥有巨大的患者资源,在医学研究和发展中占有重要地位。随着监管日益严格和专业人员的不断增多,中国临床试验将越来越正规化;随着数据源的开放,将极大促进药物的研发和临床研究的进展。
以上就是临床试验机构-桐晖药业小编分享的有关“中国临床试验的现状与挑战”的全部内容,供大家参考!
广州市桐晖药业有限公司是一家符合现代化管理要求的GSP公司,在进口原料药细分领域是为业界翘楚,为客户提供专业的从药学研发、临床预BE到临床BE的药厂研发一站式解决方案。目前的重点业务主要包括:原料药联合申报、参比制剂一次性进口、临床预BE/正式BE和一致性评价服务。如需合作,欢迎来电咨询!