什么是临床试验?
按照国家食品药品监督管理局颁布的《药物临床试验质量管理规范》中临床试验的定义,临床试验是指任何在人体(病人或健康志愿者)进行药物的系统性研究,以证实或揭示试验药物的作用、不良反应及/或试验药物的吸收、分布、代谢和排泄,目的是确定试验药物的疗效与安全性。在国外,把参加临床试验的人员称作志愿者,国内一般称为“受试者”,志愿者里面有健康的人,也有病人,这主要看是参加什么样的试验。我们平时接触最多的试验,还是由病人参加的,目的在于考察新药有没有疗效,有没有副作用的试验,换另一种更直白的说法,就是在一个新药正式上市前,医生让病人服用(使用)这个新药,当然这必须得到病人的同意,经过一定的疗程后,看看这个药的疗效和副作用情况。临床试验最重要的一点就是必须符合我们的伦理要求,就是说参加试验的是人,必须尊重他(她)的人格,参加试验必须符合参加试验者的利益,在这种前提下,试验才能做。而且在试验期间,参加者可以不需要任何理由,而不再继续进行试验,他(或她)的选择,包括医生在内的所有人都无权干涉。总之,精心设计、操作的临床试验,是提高人类健康,寻找新的治疗药物和方法的,最快最安全的途径。
临床试验的内容
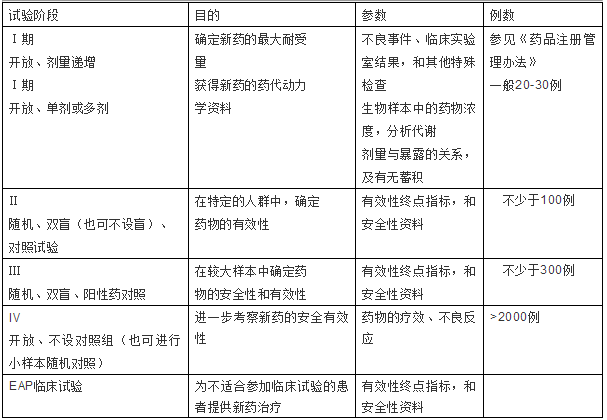
Ⅰ期临床试验
包括初步的临床药理学、人体安全性评价试验及药代动力学试验,为制定给药方案提供依据。包括:耐受性试验:初步了解试验药物对人体的安全性情况,观察人体对试验药物的耐受及不良反应。 药代动力学试验:了解人体对试验药物的处置,即对试验药物的吸收、分布、代谢、消除等情况。
① 试验开始前必须获得国家食品药品监督管理总局(简称CFDA)药物临床试验批件。
② 临床研究方案设计,记录表编制,SOP制定。
③伦理委员会审定I期临床研究方案、知情同意书、病例报告表等试验相关文件。
④研究人员培训,I期病房的准备
⑤ 通过体检初选自愿受试者,然后进一步全面检查,合格者入选。
⑥试验开始前,对合格入选的受试者签订知情同意书。
⑦单次给药耐受性试验
⑧多次给药耐受性试验
⑨数据录入与统计分析
⑩ 总结分析
Ⅱ期临床试验
治疗作用初步评价阶段。其目的是初步评价药物对目标适应症患者的治疗作用和安全性,也包括为III期临床试验研究设计和给药剂量方案的确定提供依据。此阶段的研究设计可以根据具体的研究目的,采用多种形式,包括随机盲法对照临床试验。Ⅱ期试验必须设对照组进行盲法随机对照试验,常采用双盲随机平行对照试验(Double-Blind, Randomized, Parallel Controlled ClinicalTrial)。双盲法试验申办者需提供外观、色香味均需一致的试验药与对照药,并只标明A药B药,试验者与受试者均不知A药与B药何者为试验药。如制备A、B两药无区别确有困难时,可采用双盲双模拟法(Double-Blind, Double Dummy Technique),即同时制备与A药一致的安慰剂(C),和与B药一致的安慰剂(D),两组病例随机分组,分别服用2种药,一组服A+D,另一组服B+C,两组之间所服药物的外观与色香味均无区别。
Ⅲ期临床试验
治疗作用确证阶段。其目的是进一步验证药物对目标适应症患者的治疗作用和安全性,评价利益与风险关系,最终为药物注册申请的审查提供充分的依据。试验一般应为具有足够样本量的随机盲法对照试验。
Ⅲ期临床试验中对照试验的设计要求原则上与Ⅱ期盲法随机对照试验相同,但Ⅲ期临床的对照试验可以设盲也可以不设盲进行随机对照开放试验(Randomized Controlled Open Labeled Clinical Trial)。某些药物类别,如心血管疾病药物往往既有近期试验目的如观察一定试验期内对血压血脂的影响,还有长期的试验目的如比较长期治疗后疾病的死亡率或严重并发症的发生率等,则Ⅲ期临床试验就不单是扩大Ⅱ期试验的病例数,还应根据长期试验的目的和要求进行详细的设计,并做出周密的安排,才能获得科学的结论。
Ⅳ期临床试验
IV期临床试验为新药上市后由申请人进行的应用研究阶段。其目的是考察在广泛使用条件下的药物的疗效和不良反应、评价在普通或者特殊人群中使用的利益与风险关系以及改进给药剂量等。
IV期临床试验技术特点:
① Ⅳ期临床试验为上市后开放试验,不要求设对照组,但也不排除根据需要对某些适应症或某些试验对象进行小样 本随机对照试验。
② Ⅳ期临床试验病例数按SFDA规定,要求>2000例。
③ Ⅳ期临床试验虽为开放试验,但有关病例入选标准、排除标准、退出标准、疗效评价标准、不良反应评价标准、判定疗效与不良反应的各项观察指标等都可参考Ⅱ期临床试验的设计要求。
EAP临床试验(expanded access program)
EAP临床试验是指制药企业为了让患有严重疾病且不适合参加对照试验的患者,在特定的条件下,能够得到正处于临床试验阶段的研究新药的治疗,而开展的一类临床试验。
绝大部分的新药临床试验采用对照的设计以评估新药的安全性和有效性。来自这些临床试验的数据通常可被用于决定该药是否安全有效,并作为药物上市申请的基本依据。但有时,病人由于自身健康状况,年龄及其他因素不符合参加这些对照试验的条件,或其他原因不能被入选(例如,病人居住地距离临床研究中心过远)。
这些患有严重疾病的患者有可能能从新药的治疗中获益,但却不能参加该药的临床试验。为了使这一类的病人也能受益,美国国家药监局FDA允许这类药物的生产企业向那些病人提供在特定条件下获得新药治疗的机会,称之为“扩展的途径”。
临床试验参数范例
以上就是临床试验机构-桐晖药业小编分享的有关“浅谈临床试验和试验内容”的全部内容,供大家参考!
广州市桐晖药业有限公司是一家符合现代化管理要求的GSP公司,在进口原料药细分领域是为业界翘楚,为客户提供专业的从药学研发、临床预BE到临床BE的药厂研发一站式解决方案。目前的重点业务主要包括:原料药联合申报、参比制剂一次性进口、临床预BE/正式BE和一致性评价服务。如需合作,欢迎来电咨询!