临床试验注册是临床试验领域最重要的变革之一,是临床试验透明化的重要组成部分。临床试验透明化包括临床试验注册、清楚准确报告结果、共享临床试验结果数据及共享原始数据三部分,是 21 世纪医学研究领域最重要的革命性理念。循证医学对证据质量的理念促进了以 CONSORT 为代表的临床试验报告规范的制订,进而催生了临床试验透明化理念的产生,该理念又促进大量临床试验规范的产生,推动了从医学研究伦理到临床试验管理的深层次变革。
2007 年 7 月 26 日,由世界卫生组织(WHO)宣布,中国中央人民政府门户网站和新华社同步报导,中国临床试验注册中心代表我国正式成为世界卫生组织国际临床试验注册协作网(World Health Organization International Clinical Trial Registry Platform,WHO ICTRP)一级注册机构,至今已整整 10 年。本文旨在总结 10 年来我国临床试验注册事业的发展状况,尤其列举所存在的问题并分析其原因,以促进我国临床试验注册的进一步发展,引领我国临床试验变革关键的第一步。
1、中国临床试验的注册数量
中国临床试验注册数量的增长可谓突飞猛进,从 2005 年的 7 个和 2006 年的 48 个开始,2007 年达到 240 个临床试验;2013 年突破 1 000 个后,2016 年猛增到 2 617 个,2017 年 12 月 31 日达到创纪录的 3 939 个(图 1),在成为 WHO ICTRP 一级注册机构 10 周年之际(截至 2017 年 7 月 26 日时),总量已达 14 241 个临床试验,成为 16 个一级注册机构中仅次于美国 clinicaltrial.gov、日本临床试验注册协作网、英国 ISRCTN、澳大利亚-新西兰 ANZCTR 临床试验注册研究数量的注册机构,位列第 5。
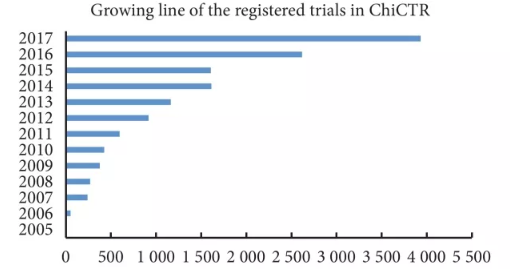
图1 2005~2017 年中国临床试验注册中心注册的临床试验数量图
2、中国临床试验注册中心注册的临床试验来源
中国临床试验注册中心主要受理中国的临床试验注册,至 2017 年 12 月 31 日,共注册了在中国实施的临床试验 14 174 个(99.52%),还接受了来自其他国家的 67 个临床试验的注册(0.48%),其中巴基斯坦 7 个、伊朗 4 个、波兰 8 个、土耳其 6 个、美国 3 个、泰国 17 个、意大利 16 个、俄罗斯 5 个、韩国 1 个。
3、新建机构
2009 年 12 月香港中文大学临床试验与生物统计中心临床试验注册中心(Centre for Clinical Research and Biostatistics,CCRB Clinical Trial Registry)经 WHO 国际临床试验注册协作网批准成为中国临床试验注册中心第一个二级注册机构(Partner Registry),机构所在地为香港中文大学,主要负责在中华人民共和国香港特别行政区实施的临床试验注册。
2016 年 7 月 26 日由中国中医科学院联合中国针灸学会和世界针灸联合会建立的针灸临床试验注册中心,经 WHO 国际临床试验注册协作网主管官员考察验收后,批准为中国临床试验注册中心第二个二级注册机构,机构所在地为北京中国中医科学院针灸研究所,主要负责全球范围内针灸类临床试验的注册。
2016 年 12 月 15 日,在香港浸会大学建立了中国临床试验注册中心香港中心,主要从事临床试验方法学研究、培训和推广。
4、临床试验注册的新变化
4.1 未获得伦理委员会批准文件时的预注册
因临床试验注册在我国的许多医院和大学越来越受到重视,一些医院或大学的伦理委员会要求先获得注册号后再受理伦理审查。为支持伦理委员会的工作,中国临床试验注册中心将必须先提交伦理委员会批准文件的规定调整为可在没有获得伦理委员会批准文件时进行预注册,但要求研究者通过伦理审查后立即向中国临床试验注册中心补充提交伦理审查委员会批准文件,否则不能最终提交。
4.2 在中国临床试验注册中心注册成为申请课题立项的必须条件
我国一些医院、大学和地区高度重视临床试验注册工作,目前已将预先注册作为申请课题立项和资助的必须条件,如上海申康医院发展中心在课题申报书中要求必须有中国临床试验注册中心注册号;一些大学和医院也建立了单位账户,要求本单位研究课题全部进行注册和统一管理。我们呼吁未来所有开展临床试验的机构建立和规范临床试验注册制度,在课题申报阶段就实施临床试验注册,这样既促进了本单位科研工作的规范化管理,也为临床试验注册事业的发展贡献了自己的力量。
4.3 注册时要求提供的新信息
4.3.1世界卫生组织临床试验注册平台于 2015 年 8 月发布了关于支持临床试验数据共享的声明
国际医学期刊编辑委员会于 2016 年 1 月 20 日发布了关于临床试验数据共享的倡议,要求从 2019 年起在注册临床试验时必须申明原始数据共享计划。中国临床试验注册中心从 2016 年 3 月 14 日起实行必须提供原始数据共享计划(Statement of Individual Participant Data Sharing Plan)的规定。据悉,WHO ICTRP 将于不久的将来全面实行此项规定以及临床试验结果报告相关发表信息。原始数据共享计划包括两方面:一是预计共享的开始时间,国际医学期刊编辑委员会要求不迟于试验结果发表后的 6 个月内开始共享;二是共享的途径,可以通过邮件索要,也可以通过专业公共网络平台共享。由于专业公共网络平台采用了标准化数据管理系统,我们推荐采用后者进行数据共享。
4.3.2 要求提供数据管理制度信息
数据管理不规范是我国临床试验质量和可信度落后于国际先进水平的一个主要缺陷。为了促进我国临床试验研究者重视数据管理制度建设,从 2016 年 3 月 14 日起,中国临床试验注册中心要求注册时必须提供数据管理信息,包括:① 是否建立完备的数据管理委员会(Data Management Committee,DMC);② 是否有病例记录表(Case Record Form,CRF);③ 是否有电子数据采集与管理系统(Electronic Data Capture,EDC的详细信息,以此推动我国临床试验数据管理的规范化。
以上就是临床试验机构-桐晖药业小编分享的来自“中国循证医学杂志”的有关“中国临床试验注册 10 年:现状与问题”的全部内容,供大家参考!
广州市桐晖药业有限公司是一家符合现代化管理要求的GSP公司,在进口原料药细分领域是为业界翘楚,为客户提供专业的从药学研发、临床预BE到临床BE的药厂研发一站式解决方案。目前的重点业务主要包括:原料药联合申报、参比制剂一次性进口、临床预BE/正式BE和一致性评价服务。如需合作,欢迎来电咨询!