一、药品注册项目简介
药品注册,是指国家食品药品监督管理局根据药品注册申请人的申请,依照法定程序,对拟上市销售的药品的安全性、有效性、质量可控性等进行系统评价,并决定是否同意其申请的审批过程。
药品注册申请包括新药申请、仿制药申请、进口药品申请及其补充申请和再注册申请。
新药申请,是指未曾在中国境内上市销售的药品的注册申请。对已上市药品改变剂型、改变给药途径、增加新适应症的药品注册按照新药申请的程序申报。
仿制药申请,是指生产国家食品药品监督管理局已批准上市的已有国家标准的药品的注册申请;但是生物制品按照新药申请的程序申报。
进口药品申请,是指境外生产的药品在中国境内上市销售的注册申请。如果境外生产企业在中国没有合法办事机构,必须委托中国的专业机构代理注册。
补充申请,是指新药申请、仿制药申请或者进口药品申请经批准后,改变、增加或者取消原批准事项或者内容的注册申请。
再注册申请,是指药品批准证明文件有效期满后申请人拟继续生产或者进口该药品的注册申请。
二、药品注册服务内容
1.中药、天然药品注册
2.化学药品注册
3.生物制品注册(治疗用生物制品注册、预防用生物制品注册)
三、药品注册申办流程
1.新药临床研究注册流程
2.新药生产申报与审批流程
3.仿制药注册流程
4.进口药品注册证申报与审批流程
5.药品补充申请申报与审批流程
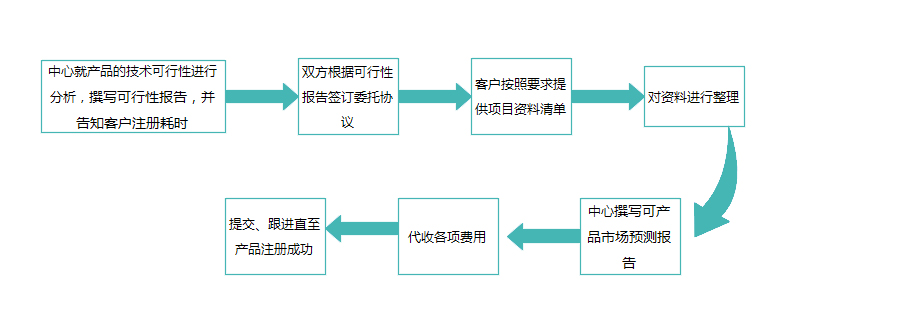
四、药品注册业务流程图