联合申报,打破发展瓶颈,重塑市场格局
针对国内原料药供应短缺现象,进口药品注册代理公司-桐晖药业提供独家的原料药注册申报服务,重塑市场格局。
| 原料药联合申报项目要点总结表 |
合作方式 | 乙方以注册申请(代理)人名义,向国家食品药品监督管理局(CFDA)申请进口药品注册证,并独家向甲方供货 | 乙方责任 | 负责翻译、整理外商提供的英文资料 |
负责审核外商提供资料的真实性,完整性以符合CFDA和中国《药品注册管理办法》对进口药品申报资料的要求 |
负责跟进进口申报的全过程 |
负责对进口质量标准进行文字校对,并翻译、转达给外商,同时也转达给甲方 |
在取得进口药品注册证后,提供满足甲方质量要求的产品 |
在取得进口药品注册证后,负责该产品在国内的进口 |
甲方责任 | 对乙方注册申报期间的工作给予积极配合和支持 |
按时足量支付注册过程中所有的申报相关费用 |
合作流程 | 从签订协议日起,启动研发阶段的原料采购工作:贵司要到省局注册司申请红头文件(用于原料药的一次性进口,不同省份获取时间不一样)。红头文件申请下来之后给到我司递交到国家局去申请一次性进口批件,整个过程大概需要两个半月到三个月的时间。 |
签订协议后我们便会要求外商按照采购要求备货,所以从批件到手,外商发货、货发到贵司,整个发货流程大约需要2个月左右。 |
关于申报时间,我司合作的外商大多数都已有DMF文件,整一个资料的收集、翻译、整理过程大约需时4-8个月。 |
供货价格 | 研发价格 | 依据贵司采购量协商 | 正式生产采购量不低 /年(将与外商协商要求的量一致) |
大生产价格 | 外商的价格加上我司的进口成本 |
供货周期 | 2-3个月 |
保证供货时间 | 外商保证无特殊原因不得终止供货,并独家向甲方供货 |
申报优势说明 | 国内情况 | 国内无合法原料 |
质量标准低 |
未来存在原料供应问题 |
国外情况 | 可合法供应研发及后期大生产原料 |
工艺成熟、质量标准高 |
价格更优惠 |
不存在被控盘风险 |
备注: 甲方: 乙方:广州市桐晖药业有限公司 |
表1 化学药品新注册分类、说明及包含的情形
注册分类 | 分类说明 | 包含的情形 |
1 | 境内外均未上市的创新药 | 含有新的结构明确的、具有药理作用的化合物,且具有临床价值的原料药及其制剂。 |
2 | 境内外均未上市的改良型新药 | 2.1含有用拆分或者合成等方法制得的已知活性成份的光学异构体,或者对已知活性成份成酯,或者对已知活性成份成盐(包括含有氢键或配位键的盐),或者改变已知盐类活性成份的酸根、碱基或金属元素,或者形成其他非共价键衍生物(如络合物、螯合物或包合物),且具有明显临床优势的原料药及其制剂。 |
2.2含有已知活性成份的新剂型(包括新的给药系统)、新处方工艺、新给药途径,且具有明显临床优势的制剂。 |
2.3含有已知活性成份的新复方制剂,且具有明显临床优势。 |
2.4含有已知活性成份的新适应症的制剂。 |
3 | 仿制境外上市但境内未上市原研药品的药品 | 具有与原研药品相同的活性成份、剂型、规格、适应症、给药途径和用法用量的原料药及其制剂。 |
4 | 仿制境内已上市原研药品的药品 | 具有与原研药品相同的活性成份、剂型、规格、适应症、给药途径和用法用量的原料药及其制剂。 |
5 | 境外上市的药品申请在境内上市 | 5.1境外上市的原研药品(包括原料药及其制剂)申请在境内上市。 |
5.2境外上市的非原研药品(包括原料药及其制剂)申请在境内上市。 |
注:1.“已知活性成份”指“已上市药品的活性成份”
2.注册分类2.3中不包括“含有未知活性成份的新复方制剂”
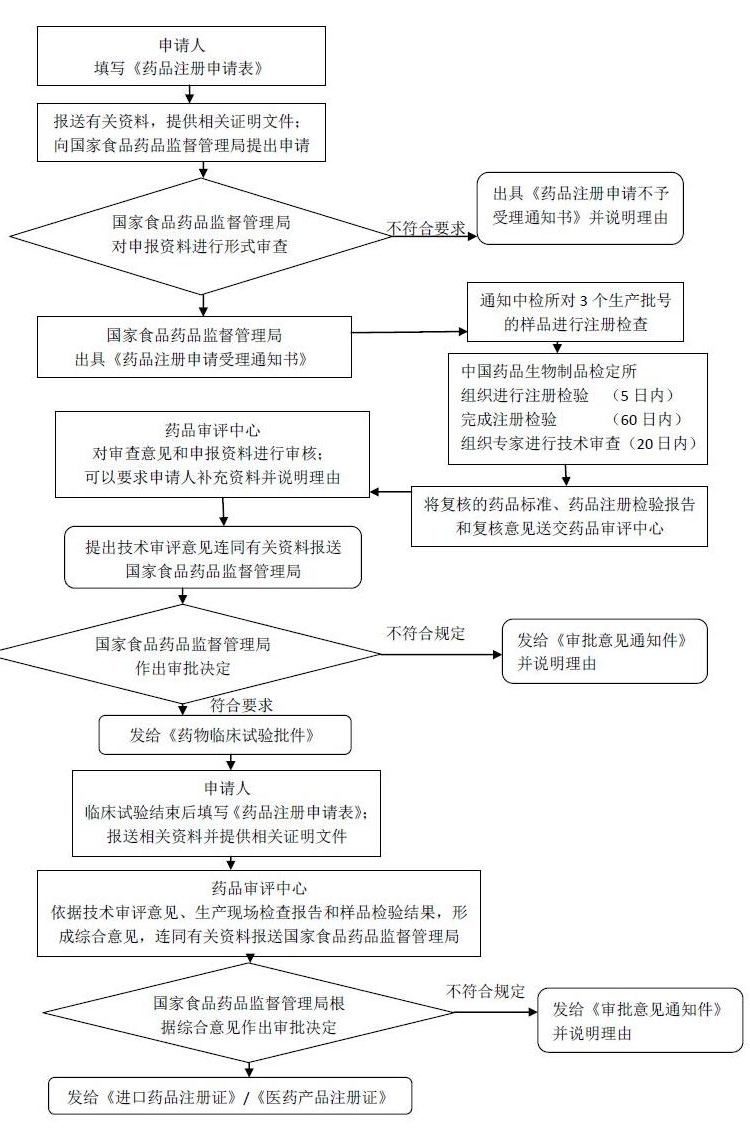
进口药品注册证申报审批流程示意图
附件:
 药品注册管理办法(修订稿).docx
药品注册管理办法(修订稿).docx