【桐晖药业】学医药的朋友,或多或少都做过各种各样的实验,不管是化学实验、生物实验还是制剂实验、药理实验,用的都是“实验”二字。所谓“实验”,《现代汉语词典》的定义是为了检验某种科学理论或假设而进行某种操作或从事某种活动。
“试验”是为了察看某事的结果或某物的性能而从事某种活动。而临床试验正是为了考察新药对目标患者的效用而展开的一系列的试验,下面,临床试验机构--桐晖药业小编就和大家讲讲新药的临床试验。
新药研发过程主要包括苗头分子的发现、细胞活性评价、非临床药理毒理研究、临床试验和上市后的安全性监督。其中临床试验耗资/耗时基本占整个新药开发的60%~80%,可谓是新药开发最耗钱耗时的阶段。FDA将临床研究分为三期,这三期临床研究通常按期依次实施,但也可以有重叠。另外针对新药批准上市后的临床研究,FDA定义其为IV期临床试验,ICHE8根据临床研究的目的将临床试验同样分为4期。
一、I期临床人体耐受性试验设计
人体耐受性试验是考察人体对药物不同剂量的耐受程度,通过试验发现出现不良反应性质和剂量。I期临床的人体耐受性试验一般先进行单剂量的探索,在此基础上确定是否进行多剂量试验。试验可以是开放、基线对照,也可以采用随机化和盲法提高观察结果的准确性。
I期临床人体耐受性试验总体设计理念:从起始剂量到最大剂量之间设若干组,各个试验组的剂量由小到大逐组进行,直至找到最大耐受剂量(MTD)或到达设计的最大剂量。
1、起始剂量
起始剂量是指从动物实验过渡到人体试验时,首次应用于人体的药物剂量。为确定Ⅰ期临床试验的安全起始剂量,需要充分了解临床前动物的药理学、毒理学及药动学数据。确定起始剂量的方法主要有以下5种。起始剂量的选择应遵循两大原则:①避免毒性反应;②能够快速达到I期临床人体耐受性试验的评估目标。
2、最大剂量
最大设计剂量通常有以下三种方法:①同一药物、同类药物或结构相似药物单次最大剂量;②动物长期毒性试验中引起中毒症状或脏器出现可逆性变化的剂量的1/10;③动物长期毒性试验中最大耐受量的1/5~1/2。最大剂量范围内应包括预期的有效剂量。
如试验达到最大剂量受试者仍无不良反应时,试验即可结束。剂量递增到出现终止指标或其他较严重的不良反应时,虽未达到最大剂量,也应终止试验。
3、剂量递增设计(爬坡试验)
在确定了起始剂量和最大剂量后,需要设计剂量递增方案,以便开展剂量递增的爬坡试验。剂量递增方案的确定要考虑起始剂量与药效学有效剂量和毒性剂量之间的距离、毒代和药代动力学特征等因素。通常采用费氏递增法(改良的Fibonacci法)设计剂量爬坡方案,即当初试剂量为n (g/m2)时,其后按顺序递增的剂量分别是2n、3.3n、5n、7n,此后则依次递增前一剂量的1/3。其特点是开始递增速度快,后期增速较慢,在确保受试者安全的情况下,以合理的速度和梯度迅速达到耐受性临床试验的终止目标。
另外剂量递增设计还有固定比例递增法,即剂量按照固定比例递增,但临床实际应用较少。对于剂量递增,也可根据具体药物的自身特点,设计更具针对性的剂量递增方案。剂量递增的基本原则:初期递增幅度可较大,后期递增幅度应较小。递增系数过小,会增加不必要的受试者例数;递增系数过大,会增加受试者的危险性。安全性大或毒性小的药物剂量递增幅度可大,有的可成倍递增;安全性小或毒性较大的药物剂量递增幅度应小。
4、最大耐受剂量(MTD)试验设计
I期临床人体耐受性试验的目标是确定人体的最大耐受剂量。在给定起始剂量、最大剂量和递增剂量的前提下,我们通过设计试验方案来确定人体的最大耐受剂量。确定最大耐受剂量的方法一般有两大类:基于规则的试验设计(Rule-Based Designs)和基于模型的设计(Model-Based Design)。
A:基于规则的试验设计(Rule-Based Designs)
关键点:未预先估计剂量-毒性曲线;剂量递增基于当前剂量水平的毒性结果;包括传统的3+3、加速滴定、PGDE试验等。
B:基于模型的设计(Model-Based Design)
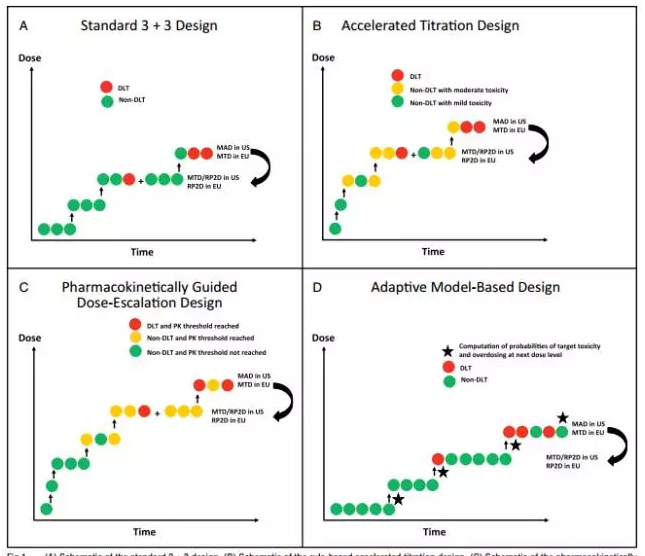
关键点:先于受试者入组前建立剂量-毒性曲线模型;试验过程中,利用受试者毒理数据实时修正剂量-毒性曲线;要求良好的生物统计学支持建立和修正剂量-毒性曲线;基于模型设计包括:CRM、Modified CRM、EWOC、TITE-CRM、mTPI、Mixed-effect POM、Fractional dose-finding试验设计等。
二、I期临床人体药代动力学试验设计
I期临床人体药代动力学试验主要目的是评价药物清除率、预测药物或其代谢物在人体可能的积聚、潜在的药物间相互作用等。I期临床人体药代动力学试验一般在人体耐受性试验之后进行。
I期临床人体药代动力学试验设计一般为随机交叉自身对照,以减少不同试验周期和个体差异对试验结果的影响。目前主要有两种试验设计:2剂量双周期交叉试验设计、3剂量3周期3×3拉丁方交叉试验设计。以下以3×3拉丁方交叉试验设计为例。
试验基本要求:受试者:9名健康男性。分组:随机分为三组,每组3人。剂量:低、中、高三剂量;高剂量必须接近或等于MTD,中剂量应与临床拟单次剂量接近或相同,三个剂量之间应呈等比或等差关系,以便观察不同剂量-血药浓度是否呈线性关系。两次试验间隔周期:≥7个半衰期。另外,药代动力学试验可考虑增加如下试验:
预实验:在正式进行药代动力学试验前,可考虑进行2-4人的预实验,以便发现可能出现的问题,并为后期的试验条件、剂量大小、观察时间、取样频率等提供参考,以期准确反应药物在人体内药代动力学过程。
食物的影响:口服固体制剂的药代动力学试验需考察餐前、餐后药动学的差异,尤其是食物对药物吸收程度的影响。
三、多剂量人体耐受性和药代动力学试验
在单剂量人体耐受性和药代动力学试验后,需进行多次给药的耐受性和药代动力学试验,以便考察新药多次给药的人体耐受性以及是否存在药物蓄积作用等。试验基本要求:受试者:一般选择8-12名健康受试者。剂量:基于II期临床试验拟定剂量范围选择1-3个剂量。给药周期:基于单剂量药代动力学中半衰期。
以上就是临床试验机构-桐晖药业小编分享的来自“浅谈:新药临床试验设计路径——I期临床试验”的全部内容,供大家参考!
广州市桐晖药业有限公司是一家符合现代化管理要求的GSP公司,在进口原料药细分领域是为业界翘楚,为客户提供专业的从药学研发、临床预BE到临床BE的药厂研发一站式解决方案。目前的重点业务主要包括:原料药联合申报、参比制剂一次性进口、临床预BE/正式BE和一致性评价服务。如需合作,欢迎来电咨询!