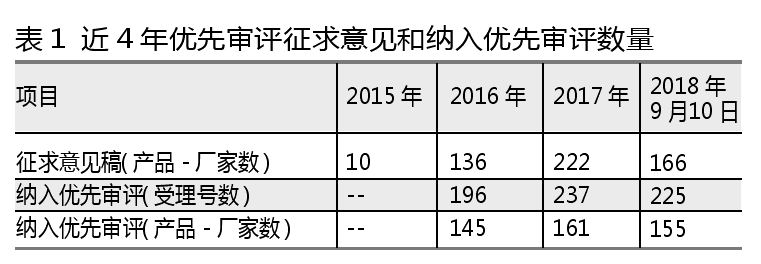
自2015年12月21日公布《实行优先审评审批的儿童用药注册申请名单(第一批)》征求意见稿以来至今,药海数据发现共有534个产品-厂家进入拟纳入优先审评征求意见名单。
而自CDE在2016年2月首次公示纳入优先审评产品清单以来,截至2018年9月10日,共有658个受理号数纳入优先审评名单,对应461个产品-厂家。
笔者对近4年纳入优先审评的461个产品-厂家进行分析发现,有129个产品-厂家的申报理由为“具有明显治疗优势”,是8种申报理由中产品数量最多的理由。
纳入名单的理由如何变化?
2015年“儿童药”→2016年“临床必需”“首仿”→2017年至今“治疗优势”
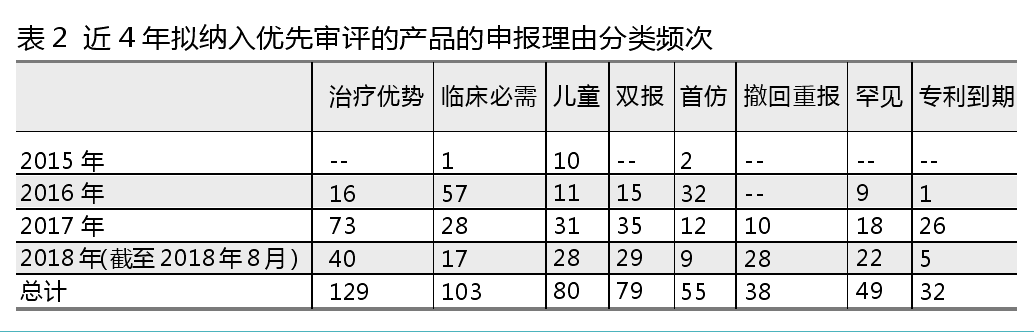
优先审评的申报理由有治疗优势、临床必需、儿童药、双报、首仿药、罕见病、撤回重报、专利到期8种。
药海数据对拟纳入优先审评产品对应的申报理由分类进行分析,如表2所示。与“现有治疗手段相比具有明显治疗优势”的理由对应的产品-厂家数最多,其中2017年以此理由申报的产品-厂家数最多。“临床必需”(不含儿童用药和罕见药)排名第二,2016年以此理由申报的产品-厂家数最多。“儿童用药”和“双报”理由纳入优先审评的产品厂家数相当,并且都是2017年申报的产品-厂家数暂时是历年最多的。
从年限来看,2015年进入拟纳入优先审批的理由主要是“儿童用药”,2016年则是以“临床必需”和“首仿”为主,2017年至今则更看重“治疗优势”。由此可见,替代现有疗法的药物作为优先审评的申报理由成为新趋势。
“治疗优势”产品为何最热?
★获批几率高,获批率超过50%
★进口药多,八成为进口药申报
★“以含中国数据的国际多中心试验结果申请免临床”
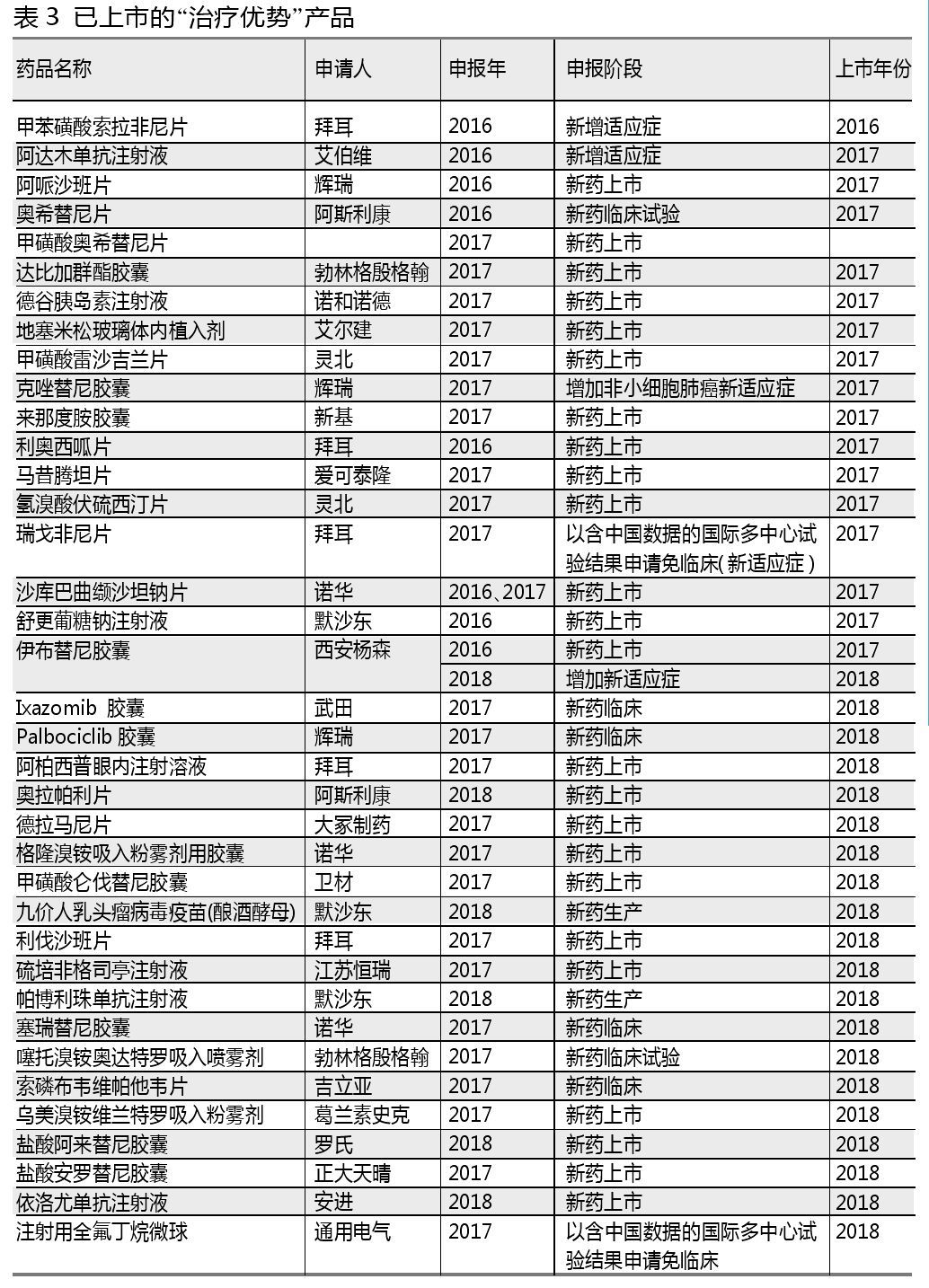
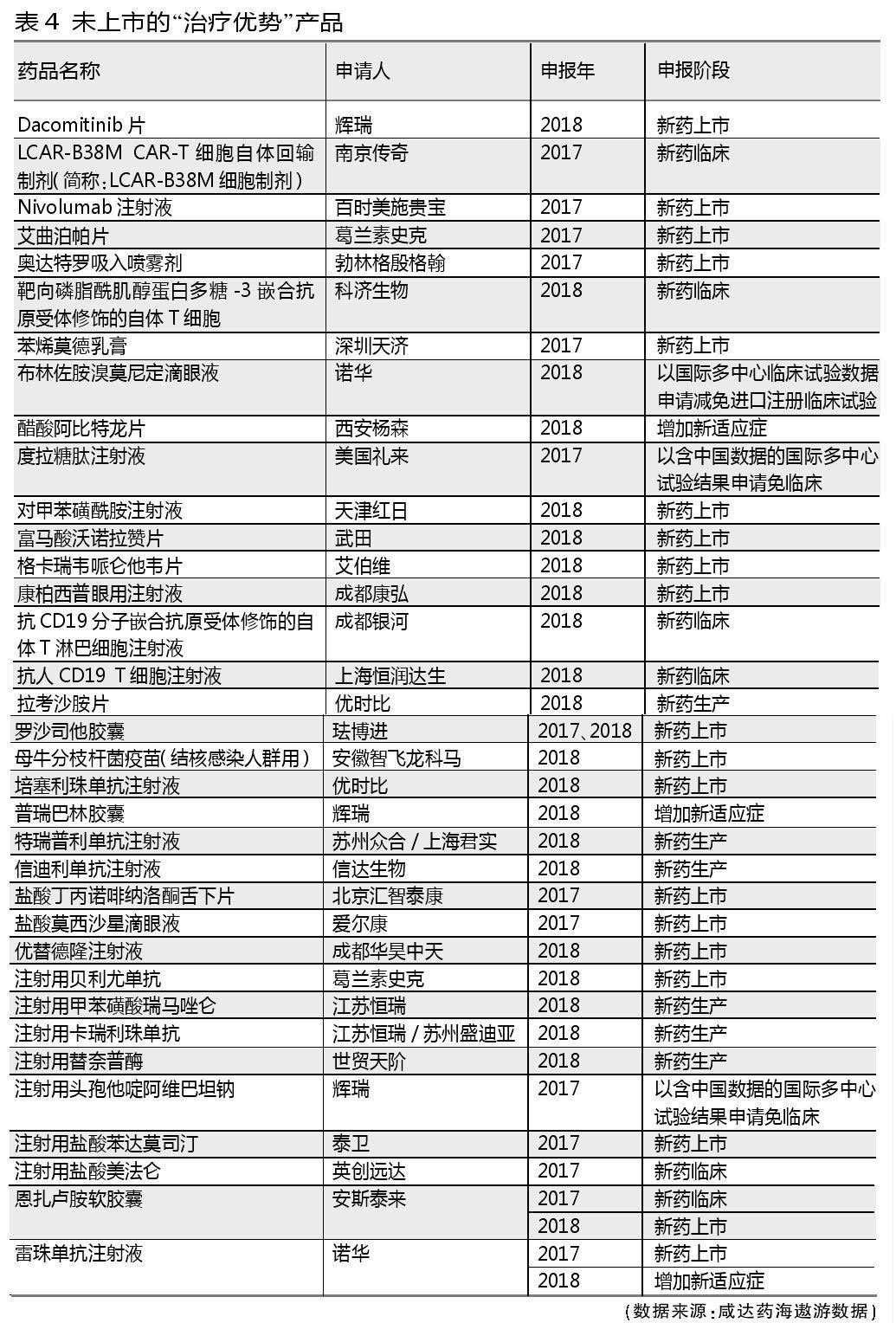
带有“具有明显治疗优势”类似字眼的申报理由都被列为“治疗优势”类别药品。此类药品获批的几率较高,71个产品中有37个已批准上市或获批增加适应症。
129个“与现有治疗手段相比具有明显治疗优势”的药品-厂家中,104个属于进口注册。拜耳是获批产品最多的进口药企,2016年甲苯磺酸索拉非尼片新增适应症,2017年利奥西呱片新药上市,瑞戈非尼片以含中国数据的国际多中心试验结果申请免临床增加新适应症,2018年阿柏西普眼内注射溶液新药上市,利伐沙班片预计是增加新适应症。
中国国内企业中,恒瑞医药(包含江苏恒瑞、上海恒瑞、江苏盛迪、苏州盛迪亚)当之无愧为申报药品数量最多的企业,申报了硫培非格司亭注射液、注射用甲苯磺酸瑞马唑仑和注射用卡瑞利珠单抗。其中硫培非格司亭注射液2018年上市。
值得注意的是,2017年起已有“以含中国数据的国际多中心试验结果申请免临床(新适应症)”的申报阶段,对应布林佐胺溴莫尼定滴眼液、度拉糖肽注射液、磷丙替诺福韦片、瑞戈非尼片、注射用全氟丁烷微球和注射用头孢他啶阿维巴坦钠6个产品。这6个产品除了磷丙替诺福韦片的申报理由是“病毒性肝炎”被归纳入“临床必需”分类之外,其余5个产品都属于“治疗优势”产品。瑞戈非尼片和注射用全氟丁烷微球分别在2017年和2018年获批。
武田的枸橼酸伊沙佐米胶囊(Ixazomib胶囊)、辉瑞的哌柏西利胶囊(Palbociclib胶囊)和吉立亚索磷布韦维帕他韦片没有申报生产只申报临床就获批生产了。这也将会是未来加快审评的新趋势。
结语
创新一般有两条路径,一是适应症没有疗法,需要发现新的疗法。另一种是替代现有疗法,比现有疗法更有临床优势。
近两年治疗优势的分类药品申报较多且获批较多,更多是出于市场的考虑,毕竟一个疗法相对空白的适应症,要让医生认识还要做医生教育。
但是,替代现有疗法的药品“可遇不可及”,近两年爆发更多是缘于2015年722临床自查核查启动以来的严格审批,以及近两年对有中国临床数据的国际多中心数据的新药的加速上市。
关键词:药品审评;临床;