药品注册是指国家食品药品监督管理总局根据药品注册申请人的申请,依照法定程序,对拟上市销售的药品的安全性、有效性、质量可控性等进行系统评价,并决定是否同意其申请的审批过程。
药品注册申请包括新药申请、已有国家标准的药品申请、进口药品申请和补充申请。
新药申请:是指未曾在中国境内上市销售的药品的注册申请。已上市药品改变剂型、改变给药途径、增加新适应症的,按照新药申请管理。
已有国家标准的药品申请:是指生产国家食品药品监督管理总局已经颁布正式标准的药品的注册申请。
进口药品申请:是指境外生产的药品在中国境内上市销售的注册申请。
补充申请:是指新药申请、已有国家标准的药品申请或者进口药品申请经批准后,改变、增加或取消原批准事项或者内容的注册申请。
进口药品注册:如果境外生产企业在中国没有合法办事机构,必须委托中国的专业机构代理注册。
再注册申请:指药品批准证明文件有效期满后,申请人拟继续生产或进口该类药品的注册申请。
新药的注册
按照《药品注册管理办法》的规定,新药是指未曾在中国境内外上市销售的药品,已上市药品改变剂型、改变给药途径的,按照新药管理。
药品注册申请人 (以下简称申请人
)是指提出药品注册申请,承担相应法律责任,并在该申请获得批准后持有药品批准证明文件的机构。境内申请人应当是在中国境内合法登记的法人机构,境外申请人应当是境外合法制药厂商。办理药品注册申请事务的人员应当是相应的专业技术人员,并熟悉药品注册管理法律、法规和技术要求。注:公民以个人名义不能注册新药。
新药的注册的详细申请
申请药品注册,申请人应当向所在地省、自治区、直辖市药品监督管理局提出,并报送有关资料和药物实样;申请新药注册所报送的资料应当完整、规范,数据必须真实、可靠
;引用文献资料应当注明著作名称、刊物名称及卷、期、页等
;未公开发表的文献资料应当提供资料所有者许可使用的证明文件。外文资料应当按照要求提供中文译本。
国家药品监督管理局对下列新药申请可以实行快速审批:
(一
)未在国内上市销售的来源于植物、动物、矿物等药用物质制成的制剂和从中药、天然药物中提取的有效成份及其制剂;
(二
)未在国内外获准上市的化学原料药及其制剂、生物制品;
(三 )抗艾滋病病毒及用于诊断、预防艾滋病的新药,治疗恶性肿瘤、罕见病等的新药;
(四
)治疗尚无有效治疗手段的疾病的新药。
申请人在提出药品注册申请时,应当承诺所有试验数据均为自行取得并保证其真实性。
申请人委托其他机构进行药物研究或者进行单项试验、检测、样品的试制、生产等,应当与被委托方签订合同。申请人应当对申报资料中的药物研究数据的真实性负责。
为申请药品注册而进行的药物临床前研究,包括药物的合成工艺、提取方法、理化性质及纯度、剂型选择、处方筛选、制备工艺、检验方法、质量指标、稳定性,药理、毒理、动物药代动力学等。中药制剂还包括原药材的来源、加工及炮制等;生物制品还包括菌毒种、细胞株、生物组织等起始材料的质量标准、保存条件、遗传稳定性及免疫学的研究等。
申请人应当对所申请注册的药物或者使用的处方、工艺等,提供在中国的专利及其权属状态说明,并提交对他人的专利不构成侵权的保证书,承诺对可能的侵权后果负责。药品注册申请批准后发生专利权纠纷的,当事人应当自行协商解决,或者依照有关法律、法规的规定,通过司法机关或者专利行政机关解决。
进口药品的注册申请
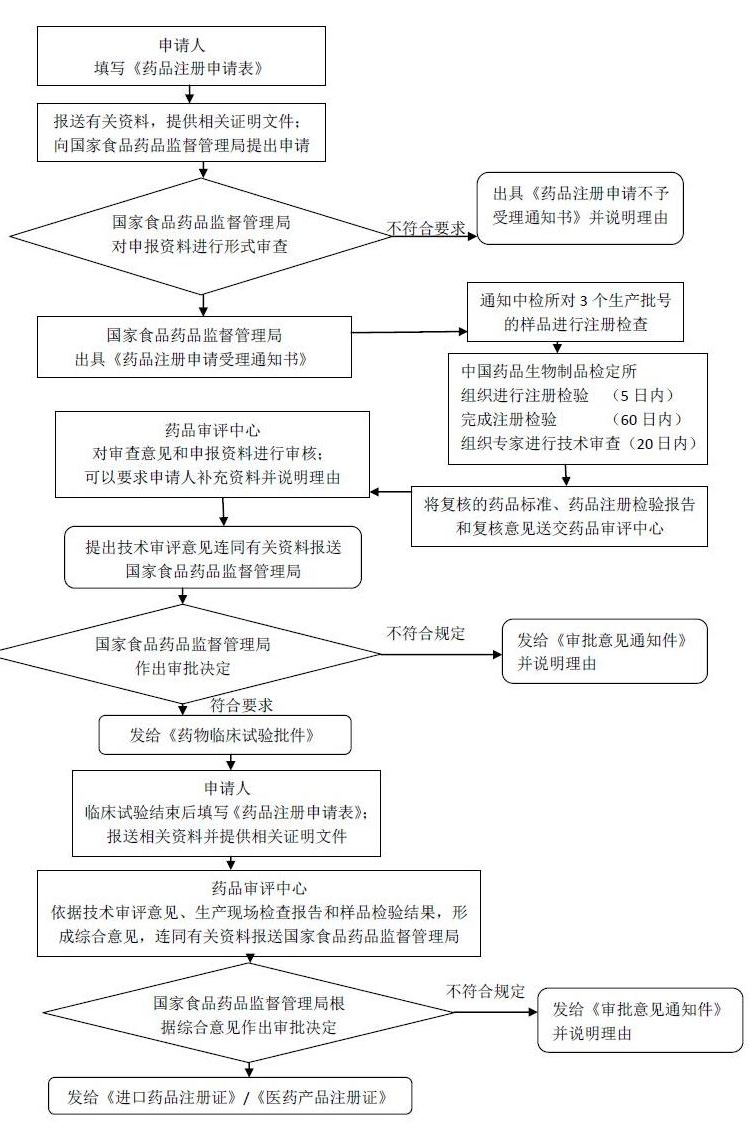
一直以来,进口药品的注册申请都是一项漫长而又繁琐复杂的过程,特别是中间一环节要是出现差错,往往又得重新提交申请,现在以桐晖药业所提供的注册申报服务为大家详细分析进口药品注册申请所需要的流程。
进口药品注册分类主要分为以下几种情况:

进口药品的注册申报流程图如下:
针对这一现状,桐晖药业为大家提供独家的药品注册申报服务,打破发展瓶颈,重塑市场格局。

桐晖药业是一家符合现代化管理要求的GSP(CRO)公司,在进口原料药细分领域是为业界翘楚,在近20年的发展历程中,公司始终秉持“创新、专业、诚信、自律”的经营理念,拥有专业的市场营销队伍,经过多年的市场拓展,已建立起覆盖全中国的营销网络。

桐晖药业的重点业务涵盖了从制剂学术推广及销售,到制剂、原料药、化工中间体销售及代理。拥有以上产品的自营进出口权,目前代理国外进口原料、代理制剂、正在申报的进口药品注册证上千个,专业为客户提供专业的从药学研发、临床预BE到临床BE的药厂研发一站式解决方案。
目前的重点业务主要包括:原料药联合申报、参比制剂一次性进口、临床预BE/正式BE和一致性评价服务,欢迎咨询合作。