近日,强生旗下杨森制药公司宣布美国食品药品监督管理局(FDA)批准其长效非典型抗精神病药物INVEGA
HAFYERA™(每6个月给药一次的棕榈酸帕利哌酮)上市,该产品是首个并且是唯一一个每年仅注射两次的用于治疗成人精神分裂症药物。
棕榈酸帕利哌酮是由强生公司开发,2006年12月经美国FDA批准上市,是第二代抗精神病药帕利哌酮的长效注射剂,也是2003年来第一个被批准的用于治疗精神分裂症的新型药物,是利培酮的主要代谢产物。
帕利哌酮的作用机制是通过中枢多巴胺2(D2)受体和5-羟色胺(5HT2A)受体拮抗的联合作用介导的,另外,帕利哌酮也是α1和α2肾上腺素能受体以及H1组胺受体的拮抗剂。棕榈酸帕利哌酮能有效克服其他长效抗精神病药物的时滞壁垒,可同时用于精神分裂症急性期和维持期的治疗。
此外,帕利哌酮不会引起肝脏的广泛代谢,并且通过肾进行大量分泌而不发生变化,具有非典型性治疗精神分裂症药物所特有诸如不自主运动或震颤等副作用的特点,在安全性和耐药性等方面均优于传统药物奥氮平,同时更少发生代谢障碍,因此具有良好的应用前景。
棕榈酸帕利哌酮(Paliperidone
palmitate)是早期抗精神病药物利培酮(Risperidone)的体内主要活性代谢产物帕利哌酮(Paliperidone)的棕榈酸前药[2],作用机制为DRD2拮抗剂、5-HT2A拮抗剂。目前FDA已经批准四款帕利哌酮上市用于治疗精神分裂症。
相关数据显示,自棕榈酸帕利哌酮上市以来,销量一直在逐年增长,2017年,棕榈酸帕利哌酮的全球销售额达32亿美元,其中中国的销售额为4640万元人民币,在2020年年,全球的销售已经达到了36.53亿美金,可以说不管是国际还是国内市场前景十分广阔。
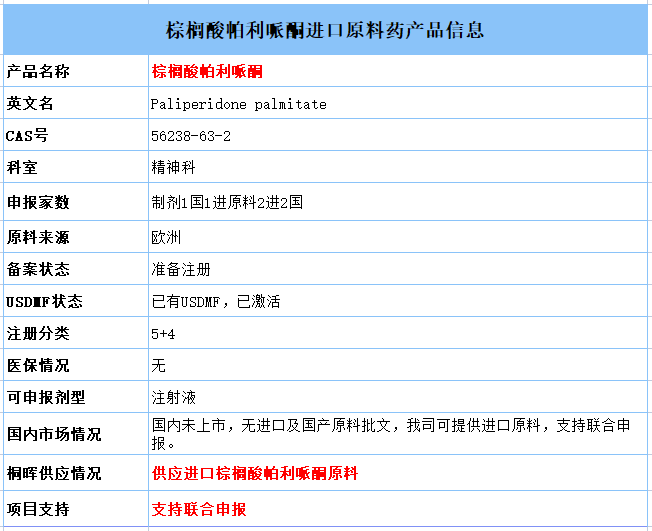
目前,中国批准的三款帕利哌酮产品目前已经全部进入2020年国家医保乙类目录中,用于精神分裂症的治疗。仅帕利哌酮缓释片和棕榈酸帕利哌酮注射液进入国家基药目录。三款产品均没有进入集采范围。在国内未上市,无进口及国产原料批文,我司可提供进口原料,支持联合申报。