在日本,仿制药因质量和疗效一度不为公众所信任,致其使用远不如欧美广泛。作为福利国家,随着人口老龄化和医药费用增长,政府的医保压力日益增加,日本采取了一系列措施推动仿制药替代。
日本历史上共进行了3次药品再评价工程,主要分为针对有效性、安全性进行的药效再评价、针对质量一致性进行的质量再评价,以及质量一致性和药效再评价。质量一致性和药效再评价也称“药品品质再评价工程”,是最大规模的一次仿制药一致性评价,采用体外溶出曲线验证的方法。此项工程极大地促进了日本仿制药企业对于生产工艺的深入研究,提升了药品质量,同时冲击了水平低下的中小制药企业,优化了整体医药产业结构,对我国现阶段和未来仿制药一致性评价工作的开展有很强的借鉴意义。
历史进程
第一次:药效再评价
日本的第一次药品再评价可以追溯到1971年,对1967年9月前审批的药品进行药效再评价,方法主要参考了美国的DESI。这项工程为时17年,共进行了29次再评价工作,评价了约8000个品种,占全部对象品种的98.6%,评价结果显示约5.6%的品种没有有效性。此后,药品再评价制度于1980年4月写入日本《药事法》。
第二次:质量一致性再评价
第二次再评价开始于1984年,针对1967年10月-1980年3月之间审批的药品中新有效成分、新处方、新功效、新用量、新剂型和新工艺进行质量一致性再评价。
第三次:质量一致性和药效再评价
第三次再评价于1998年展开,是对所有仿制药(主要是口服固体制剂)进行质量一致性和有效性再评价,共评价了700多个化学药品、4588个批准文号。其中,通过4135个、撤销453个,撤销占比9.87%。
基本情况
实施机构及职责
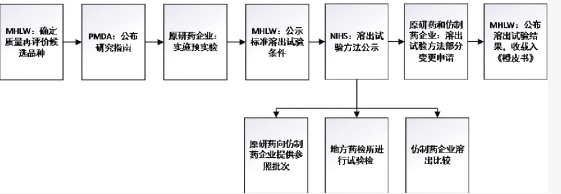
日本仿制药再评价由厚生劳动省(MHLW)主导,国立医药品食品卫生研究所(NIHS)、医药品医疗器械管理局(PMDA)等多部门共同负责实施。
MHLW作为药品监管中枢机构,负责成立质量一致性评价小组,对参与评价的仿制药品种进行初步拟订,制订《医疗用医药品品质情报集》(即《橙皮书》),公布药品的有效成分、部分理化性质、制剂类型与规格、药品生产厂家、溶出试验参数、4条标准溶出曲线、该制剂的溶出度试验质量标准。
NIHS是属于日本厚生劳动省的试验研究机构,主要承担具体技术细节和指导工作,包括口服固体仿制药品溶出曲线方法的建立、修正和复核,以及仿制药质量一致性的监督抽查工作。
PMDA是药品和医疗器械审评中心(PMDEC)、日本医疗器械促进协会(JAAME)和药品安全性和研究机构(OPSR)合并形成的管理药品、生物制品和医疗器械的机构,是日本医疗产品管理的基础。在仿制药一致性再评价中负责处方、工艺变更的资料审查。
再评价流程
日本的仿制药一致评价采用体外溶出试验来代替体内的生物等效性实验进行评价(在4种不同pH溶出介质中根据溶出行为绘制溶出曲线,并计算出溶出度相似因子,以此评价仿制药与原研药是否具有相似的生物利用度),具有干扰少、灵敏度高、操作简便、花费少的优点。需要注意的是,日本在仿制药上市审批时已经开展过BE并提交相关数据,在此基础上通过溶出曲线验证来确认是否生物等效。
再评价流程中主要包括品种拟定、药品再评价溶出度预实验及确认、仿制药生产企业全面的溶出度考察、再评价结果的公布等步骤。在品种选定方面,MHLW主要根据以下3个原则:①生产金额高,市场占有率大的品种;②仿制药质量存疑的品种;③多标准的品种。除了仿制药企业,原研药企业在整个再评价过程中也起着重要的作用,包括预实验方法的确定、参比制剂的提供等。
启示与建议
1.利用体外溶出度试验,完善橙皮书
日本的仿制药再评价是将溶出度评价作为主要手段,具有很强的实践意义,我国要想实现仿制药一致性的长期监管还需依靠体外溶出度试验。2017年9月4日,国家药品食品监督管理总局药品审评中心公开征求对《中国上市药品目录集》基本框架结构与信息的意见和建议,我国可以借鉴日本的方法,在溶出度上明确要求,完善我国的橙皮书,以此为基础促进仿制药品质的提升。
2.充分考虑我国医药工业现状,合理稳步推进
与日本情况不同,我国药品生产企业、批准文号众多,医药产业结构中仿制药比例极高,而参比制剂的选择逐步转向国际上发达国家的标准。考虑到企业的实力水平各异,在仿制药一致性评价政策时间紧、要求高的情况下,其势必会对我国的医药产业造成巨大的冲击。因此在政策推进的过程中,应充分考虑我国医药工业现状,包括参比制剂的可获得性、临床资源的紧缺性等,妥善处理评价工作可能带来的问题,使仿制药一致性评价工作合理有序地开展。
3.完善法律法规体系,建立激励机制
仿制药一致性评价是历史发展中的阶段性政策,其改革的进程也是相关立法完善的进程。美日的仿制药一致性评价均推动了相关立法,如美国的《药品有效性证据法规》、日本的《药事法》。我国目前主要出台了相关规范性文件,未充分具备行政法规效力,应进一步完善法律法规体系,建立仿制药上市后再注册和再评价制度,并通过相关在招标、医保中的激励政策提高生产企业参与一致性评价工作的积极性。
以上就是仿制药一致性评价公司--桐晖药业小编分享的有关“真相!日本仿制药一致性评价制度启示”的全部内容,供大家参考!
广州市桐晖药业有限公司是一家符合现代化管理要求的CRO公司,在进口原料药细分领域是为业界翘楚,为客户提供专业的药学研发、临床预BE、临床试验等临床评价服务,实现药学到临床一站式服务解决方案。目前的重点业务主要包括:原料药联合申报、参比制剂一次性进口、临床预BE/正式BE和一致性评价服务。如需合作,欢迎来电咨询!