现行仿制药质量一致性评价工作方案和技术策略
1.仿制药质量一致性评价办公室已正式发布的信息
我们从中国食品药品检定研究院的二级网站仿制药质量一致性评价办公室官网检索到以下正式公开发布的关于仿制药质量一致性评价工作的相关信息:①CFDA办公厅关于2013年度仿制药质量一致性评价方法研究任务的通知(食药监办药化管[2013]38号),部署国内药品检定机构就75个口服固体制剂体外溶出方法开展研究,以用于一致性评价。②《仿制药质量一致性评价工作方案》。③《口服固体制剂参比制剂确立原则(草案)》和《普通口服固体制剂溶出曲线测定与比较指导原则(草案)》。④5个药品:盐酸氨溴索片、盐酸特拉唑嗪片、盐酸奈韦拉平片、头孢呋辛酯片、酒石酸美托洛尔片的溶出曲线一致性评价方法(草案)
2.现已形成的技术策略综合现已发布的信息,汇总形成以下技术策略图:
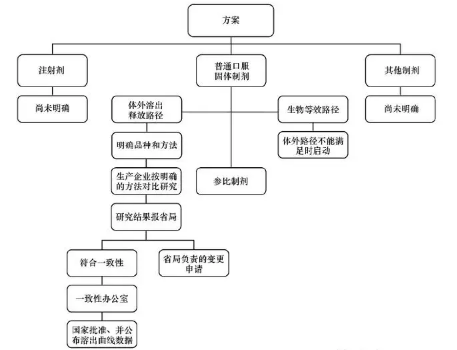
技术策略以文字概括如下:以常规口服固体制剂启动此项工作。将药品的体外溶出曲线的比较作为我国仿制药质量一致性评价的主要方法(也是目前看到发布的唯一方法),被评价的仿制药将与参比制剂进行溶出曲线的比较。其中参比制剂以企业“自主申请-专家评估-行政批准”的方式产生。药品检定机构负责体外溶出的方法学研究。
1、仿制药一致性评价的相关政策
仿制药一致性评价是指对已经批准上市的仿制药,按与原研药品质量和疗效一致的原则,分期分批进行一致性评价,仿制药需在质量与药效上达到与原研药一致的水平。
我国早期仿制药申报数量巨大,但当时批准上市的药品没有与原研药一致性评价的强制性要求,另外,企业研究人员水平参差不齐、原辅料质量、包材等也相对落后,导致大量国产仿制药属低水平仿制,疗效与原研药相比存在较大差距,有的甚至被认为是安全的无效药。为了提升已上市的仿制药质量水平,淘汰内在质量和疗效达不到要求的品种,保证公众用药安全有效,CFDA全面启动了仿制药一致性评价工作。
2016-05-26,CFDA发布的关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的公告中明确要求:国家基本药物目录(2012年版)中2007-10-01前批准的化学仿制药口服固体制剂(289个品种),应在2018年底完成一致性评价,逾期未完成的不予再注册。对其他已批准上市的药品,自首家品种通过一致性评价后,其他生产企业的相同品种在3年内仍未通过评价的,注销药品批准文号。
2、一致性评价研究存在的主要问题
一致性评价研究存在的主要问题如下①研发阶段尚未建立统一格式和内容的质量管理规范。不同于药品生产过程,药品研发过程规范性程度的法规文件尚不健全,药品注册研制现场核查中药学部分的相关要求亦无质量体系建立及有效运作方面的内容,仅仅从注册申报资料的角度判断结果的合规性与否。目前总厂研发部门也在开始进行研发质量体系的建设,但是还尚未成熟健全;②实验设计不科学,研究方案的审核流于形式,研究过程经常反复试验,产生大量无用功试验和无用原始记录;③研究过程缺乏监督和审查,往往到完成实验研究准备资料申报时,才发现各种缺陷、漏洞;④数据可靠性问题:研发实验记录不完整,实验结果不准确,无法追溯;⑤实验室研究与生产放大的衔接容易出问题;⑥研究质量和进度较难平衡,往往为了赶进度忽视了研究的质量,导致核查时出现很多问题。
3、一致性评价研究质量管理
3.1 遵循戴明环管理模式
PDCA循环由计划(Plan)、执行(Do)、检查(Check)、处理(Action)组成,作为全面质量管理应遵循的科学程序,管理活动的全部过程,在质量管理中发挥了巨大的作用。PDCA循环又名戴明环,由美国“统计质量控制之父”休哈特构想,美国质量管理专家戴明博士对其进行深度挖掘而形成的科学管理体系,被广泛应用到产品质量的管理过程中。任何一个有目的有过程的活动都可以按这四个阶段进行。在进行一致性评价研究过程中,可用PDCA循环管理模式对评价研究过程进行全面质量管理,并制定出一致性评价研究过程的科学程序和流程,从而保证在规定时间内高效高质量完成一致性评价研究工作。
首先是计划阶段,活动前预先拟定的具体内容和步骤,提出可能出现的问题和预防措施,可以增加活动的主动性,减少盲目性。一致性评价研究的计划阶段主要就是要制定研究目标与计划。
其次是执行阶段,实施阶段组织制定标准工作流程、研究报告模板,对于研究活动涉及的5大因素(人、机、料、法、环)进行规范管理,形成管理机制。按照预定的方案、标准流程、进行各项研究,并做好原始数据和记录的收集整理,保证数据和记录可靠性,形成研究报告模板。在研究阶段还应关注并紧跟国家出台的各项法规,政策,指导原则进行研究。
再次是检查阶段,一致性评价的检查阶段需要定期对评价研究过程的每一环节进行检查和评估,属于过程管理,可设立质量检查小组。检查和评估内容包括①研究的质量情况,是否符合要求。针对核查容易出问题的薄弱点重点检查,发现与预期目标的偏离的地方,从而及时进行调整和处理;②根据项目进度表检查每一节点是否按期完成,调查没有完成的原因,及时改正。检查阶段可及时的发现问题并找到解决的办法,降低研究风险。
另外处理阶段也很重要,总结研究经验并吸取教训,对于一致性评价过程中好的成果进行固化和标准化,形成标准工作流程,以便于开展其他品种的一致性评价研究。对于在检查阶段评估出来的偏差的地方,则需要分析原因,在原有标准制度上进行优化。对于尚未解决的问题要制定下一轮计划,进行新的PDCA循环。
3.2 质量源于设计(QbD)的应用和实施
QbD是一种新型的药品质量管理理念,以预先设定的目标产品质量为研发起点,强调在基于对产品及其生产工艺充分理解的基础上,采用风险管理工具识别出影响终产品质量的关键原材料属性和关键工艺参数,制订有针对性的控制策略使产品质量始终介于可接受范围内,并结合药品质量系统的运行情况(外部反馈和内部回顾)对产品质量进行持续改进。QbD理念运用于药物研发(包括一致性评价研究)是一种必然趋势。它要求企业在进行一致性评价时须对处方和工艺进行系统研究和精准控制,明确产品的关键质量属性、影响关键质量属性的关键要素及影响方式,并对其中关键要素进行控制以保证仿制药与参比制剂的一致性。
一致性评价是一个全面的系统工程,QbD理念应全面贯彻于整个研究过程:原料药理化性质,参比制剂剖析,辅料筛选和考察,有区分力溶出方法开发,处方工艺设计,质量对比研究,稳定性研究,药包材对比,BE豁免评估,预BE和BE,体内外相关性的建立,工艺验证,数据完整性评价,研制和生产现场核查,补充申请资料撰写等。任何一个环节出现偏差都有可能会影响一致性评价的结果。
4、讨论
针对仿制药质量一致性评价项目的行业建议
由以上对我国仿制药一致性评价工作的分析可以看出,我国应当对现行方案与技术策略进行及时的调整与改进,从而更为科学有效地开展评价工作。对现行方案与技术策略的调整与改进,我们建议可以尝试以下最优改进路径。倘若采取最优改进路径会遭遇不可克服的阻力,可尝试次优改进路径。
一致性评价是一个系统的工程,加强一致性评价研究过程的质量管理,是保证项目顺利、高质量完成评价的关键,是提高一致性评价研究的效率,保证最终产品质量的保障。在一致性评价研究过程中应遵循PDCA循环原则,对评价研究过程进行全面的管理,对评价的每一阶段都进行计划、实施、检查和处理。并将QbD理念和方法贯彻于一致性评价的整个研究过程,包括项目的前期调研、研究方案的设计、实验开展、实验结果的总结,分析讨论、研究报告的撰写、申报资料整理等。应紧跟政策,加强事前充分调研准备、事中过程控制、事后总结提高,加强对药品关键质量属性和关键工艺步骤与参数的理解,建立合适合理的控制策略,协调各项研究的进展和逻辑安排,为药品上市后工业化生产的源头控制、过程控制和终点控制可行性打下坚实的研究基础,最大程度地减少频繁的工艺变更及其他生产变更。通过不断的提高企业的研发实力和研究质量管理水平,企业将最终在这场优胜劣汰的角逐中脱颖而出、抢占先机。
以上就是一致性评价机构-桐晖药业小编分享的来自“研药技术交流汇”的有关“仿制药一致性评价研究的质量管理四大总结”的全部内容,供大家参考!
广州市桐晖药业有限公司是一家符合现代化管理要求的GSP公司,在进口原料药细分领域是为业界翘楚,为客户提供专业的从药学研发、临床预BE到临床BE的药厂研发一站式解决方案。目前的重点业务主要包括:原料药联合申报、参比制剂一次性进口、临床预BE/正式BE和一致性评价服务。如需合作,欢迎来电咨询!
本文关键词:一致性评价,一致性评价机构,仿制药一致性评价