【桐晖药业】最近,一部叫《我不是药神》的影片火正在热上映,该影片讲述了一名药贩帮助白血病患者从印度代购救命药的故事。让人飙泪的同时,也让观众对专利药和仿制药有了深刻的认识 。
首先必须强调一下:仿制药不同于高仿的A货名牌服装和包包,并不是假药!
国际上仿制药的名称叫做“非专利药”,是与原研药具有相同的活性成分、剂型、给药途径和治疗作用的,被法律认可的替代药品。
专利药,即在全球最先提出申请,并获得专利保护的药品,一般有20年的保护期,其他企业不得仿制。
原研药,即过了专利期的、由原生产商生产的药品。
仿制药,即专利药过了保护期,其他企业均可仿制的药品。
参考文献:2017年国家食药品监管总局文件
不得不承认的现实是,我国重要专利药物市场绝大多数被跨国药企占据。
在 2014~2017年间,新药申报临床数量由320例上升至792例,新药上市数量绝大多数依然集中在跨国药企。
为什么我国很少有受到世界范围认可的专利药呢?
究其原因,我国的科研模式,与开发新药的模式不符合,科研投入不够。
专利药的研发难度特别大,投入高。尤其对抗癌药等重症药品,每款药物的研发费用高达几十亿美元,也决定了它的价格绝对不会亲民。
首先来看一组数据:
福布斯曾公布1997年-2011年世界著名医疗公司的新药研发情况,其中生物制药巨头阿斯利康的新药平均研发成本达到了118亿美元,而格列卫的生产厂商诺华的新药研发成本在40亿美元。
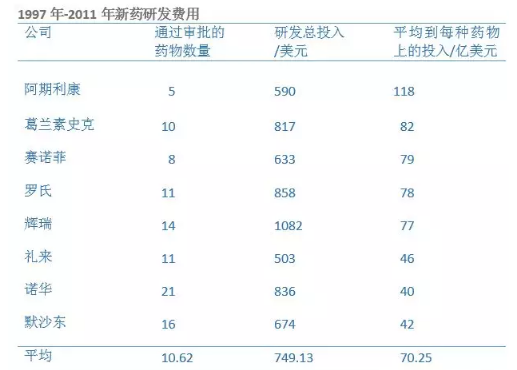
而咱国内的制药企业呢?2014年67家上市制药企业公布了研发投入,共计53.56亿元。
照这样看,阿斯利康每年的科研投入,可以抵得上670家国内制药企业了。
研发强度不可同日而语。
据统计,中国的上市知名药企的广告费都数倍于研发费用。
只有两家上市药企的研发费用超过10亿元,但这个费用赶不上国外药企在一款药品上研发费用的十分之一。
从中国的药品专利上分析,中国的药品专利主要集中在中成药领域。
对比起研发难度大、投入动辄上数亿的创新药,中成药的研发要简单得多了。
在化学药上的创新基本上属于药物剂型、化合物分子修饰或轻微改进,并不是从无到有研发一种新药。
而在全球发展最为迅猛的生物药物领域,所占市场份额却很小。
从目前看,中国距离创新药还有很长的距离。
那我国仿制药的现状又是怎样的呢?
在中国市场,发展新药困难,生产仿制药也不简单。
要知道,专利药(原研药)上市前需要经过严格的临床四期实验;
而仿制药只需证明与原研药在适应症、给药方式、剂量等方面等效即可,不需要经过大规模的临床实验。
因此,仿制药的有效性和安全性就不能得到有效的保证。
而且仿制药的原料药和辅料来源、辅料种类和配比、制备工艺等不可能和原研药完全一致,两者自然会存在疗效和安全性方面的差异。
举个例子:研究发现用仿制药卡马西平会导致服药患者癫痫发作次数增加,换回原研药后恢复正常水平。
这里还要了解一个概念:
仿制药一致性评价是指对已经批准上市的仿制药,按与原研药品质量和疗效一致的原则,分期分批进行质量一致性评价,就是仿制药需在质量与药效上达到与原研药一致的水平。
我国由于过去批准上市的药品没有与原研药一致性评价的强制性要求,部分质量与原研药差距较大,尚不能与被仿药达到同效。
也就是说,所谓的“仿制药”没有经过一致性评价,实际上是“山寨药”。
没人敢买,没人愿用。
好在,当下也迎来了转机。
2016年国家药监局开始推进仿制药质量和疗效一致性评价工作,通过对生物等效性试验和临床有效性试验等临床研究的再次推进将此前批准的仿制药过一遍“筛子”。
当年国家药监总局公布了2018年底前须仿制药质量和疗效完成一致性评价品种批准文号信息,涉及的289个品种共有17740个批准文号。
未来在市场上流通的国产药,如果印有这个标识,那就意味着,这个品规的仿制药已经通过了监管部门的质量和疗效的一致性评价,和进口原研药在质量和疗效上完全等同,在临床治疗过程中可以互相替代。
与原研药相比,通过一致性评价的仿制药,具备了“性价比高”的特性,即质量、疗效与原研产品一致,但价格相对低很多。
医特统计,截止目前,国家药监局已公布参比制剂15批1071个品规,共有4批41个品规的仿制药通过了一致性评价,详见附录。
我们期待,在大限来临之前,会有更多品种成功通过一次性评价。
以上就是广州医药研发公司-桐晖药业小编分享的来自“医特约”公众号的有关“1分钟看懂:专利药为何贵?仿制药是不是A货?”的全部内容,供大家参考!
广州市桐晖药业有限公司是一家符合现代化管理要求的GSP公司,在进口原料药细分领域是为业界翘楚,为客户提供专业的从药学研发、临床预BE到临床BE的药厂研发一站式解决方案。目前的重点业务主要包括:原料药联合申报、参比制剂一次性进口、临床预BE/正式BE和一致性评价服务。如需合作,欢迎来电咨询!