9月17日,CDE国家食品药品监督管理总局公告:药审中心化药药学一部开展化药仿制药注射剂药学研究学术交流活动。药审中心化药药学一部邀请了国内具有丰富注射剂国际注册经验的生产企业专家,于7月、8月连续组织开展化药仿制药注射剂药学研究学术交流活动。

学术交流活动上,参会审评人员结合审评工作实际与生产企业专家进行了深入讨论和交流。进一步提高了审评人员对化药仿制药注射剂药学研究技术要求的整体认识,并且,有助于化药仿制药注射剂审评,和后续即将开展的化药仿制药注射剂一致性评价工作的推进。
关于仿制药一致性评价,我国于2015年8月,国务院印发了《关于改革药品医疗器械审评审批制度的意见》,提出将“提高仿制药质量,加快仿制药质量一致性评价,力争2018年底前完成国家基本药物口服制剂与参比制剂质量一致性评价”作为改革药品审评审批制度的五大目标之一。
2016年2月,国务院发布了《关于开展仿制药质量和疗效一致性评价的意见》,一致性评价工作全面开启。要求化学药品仿制药口服固体制剂289目录,应在2018年底前完成一致性评价。
2017年10月,中共中央办公厅和国务院办公厅联合印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,再次重申要加快推进仿制药质量和疗效一致性评价。
历时3年,随着国家对一致性评价一系列的扶持政策落地,一致性评价工作持续进行。截至目前,289目录中有19个品种通过一致性评价。一致性评价工作进度还需加快进行。
而此次,药审中心组织开展化药仿制药注射剂药学研究学术交流活动,意味着我国化药仿制药注射剂一致性评价或将提上日程。尽管目前关于化药仿制药注射剂一致性评价还没有明确的标准和时间,但是化药仿制药注射剂一致性评价工作也在所难免。
事实上,仿制药注射剂的一致性评价,不少企业已经走在了前端,桐晖药业小编带大家一览目前已通过一致性评价的注射剂企业。
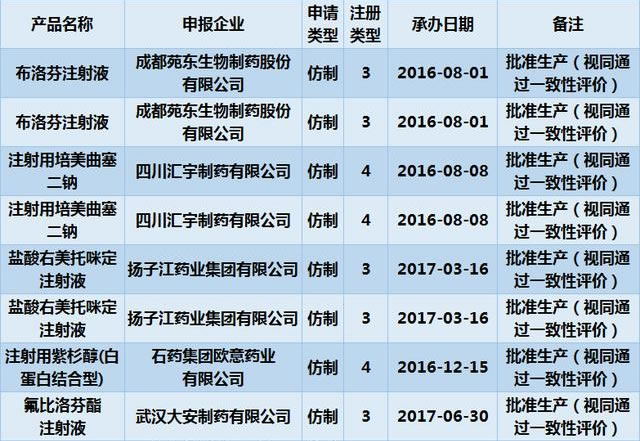
以上就是一致性评价机构-桐晖药业小编分享的有关“注射剂一致性评价或将提上日程,你准备好了吗?”的全部内容,供大家参考!
广州市桐晖药业有限公司是一家符合现代化管理要求的GSP公司,在进口原料药细分领域是为业界翘楚,为客户提供专业的从药学研发、临床预BE到临床BE的药厂研发一站式解决方案。目前的重点业务主要包括:原料药联合申报、参比制剂一次性进口、临床预BE/正式BE和一致性评价服务。如需合作,欢迎来电咨询!