放射性药物简介
放射性药物(简称“放药”)是指一类含放射性核素用于诊断或治疗疾病的特殊药品,它是核医学发展的基石,在心血管疾病、神经退行性疾病,尤其是恶性肿瘤等疾病的诊断和治疗等方面日益发挥着重要的作用。
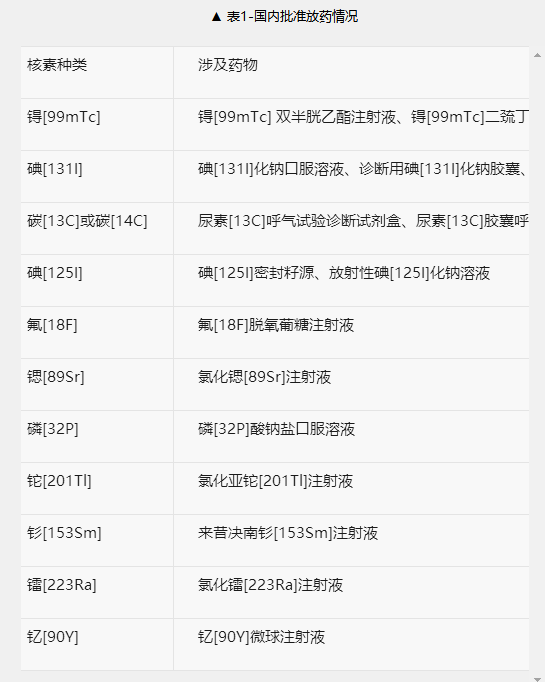
目前,国内已累计批准的放药有30 余种,共涉及11种核素(含2种进口药物),其中锝[99mTc]药多达12种。近10 余年,国内放药领域更是没有本土原研创新药获批上市。
参比制剂遴选与发布
根据国内药品注册分类要求,化学药品注册分类共分为5类,分别为1类(境内外均未上市的创新药)、2类(境内外均未上市的改良型新药)、3类(境内申请人仿制境外上市但境内未上市原研药品的药品)、4类(境内申请人仿制已在境内上市原研药品的药品)和5类(境外上市的药品申请在境内上市)。其中,3/4类均为仿制药,在进行注册申报时均需提交参比制剂相关信息。
参比制剂是指在仿制药开发过程中被仿制的对照药品,它的遴选应以为公众提供高质量的仿制药品为目标,一般采用境内外首个获批上市且具有完整和充分安全性、有效性数据的原研药品或在美国、日本或欧盟等批准上市并获得参比制剂地位的国际公认同种药品。注:原研药品指境内外首个获准上市,且具有完整和充分的安全性、有效性数据作为上市依据的药品。
根据国家药监局关于发布化学仿制药参比制剂遴选与确定程序的公告(2019年第25号),参比制剂由药品生产及研发企业或行业协会按照一定原则,通过参比制剂遴选申请平台向国家药监局药审中心提出申请,药审中心对申请资料进行审核并提交专家委员会审议,最终报国家药监局进行发布。原国家食品药品监督管理总局于2017年03月17日发布仿制药参比制剂目录(第一批),共涉及51个品种。截止到2023年01月31日,国家药监局(含原国家食品药品监督管理总局)已累计发布仿制药参比制剂目录六十四批。
放药参比制剂现状与展望
根据已发布的六十四批仿制药参比制剂目录,共涉及放射性药品31种,从涉及核素分布来看,共涵盖氟[18F]、锝[99mTc]、镓[68Ga]和碳[13C]或碳[14C]等10种核素,其中氟[18F]药11种、锝[99mTc]药8种,两者合计占比超过60%,见图1;从药品功能来看,大部分为诊断药物,诊断用药物有26种,氟[18F]药、锝[99mTc]药分别用于PET-CT显像、SPECT显像,治疗用药物仅有5种;从参比制剂来源来看,28种参比制剂为未进口原研药品,2种参比制剂为国际公认的同种药品,仅有一种氯化锶[89Sr]注射液为国内上市的原研药品;从发布时间来看,在国家药监局发布的第一批至第五十二批仿制药参比制剂目录中均无放药品种,2022年04月24日仿制药参比制剂目录(第五十三批)首次出现放药身影,在随后不到一年时间里陆续有30余种药物发布。
当前,国内临床应用较多的放药多为仿制药,且大多以诊断用途为主,主要集中在氟[18F]和锝[99mTc]两种核素,治疗用药物相对较少,多年无原研创新药获批上市,放药技术研发和监管体系与国外也存在一定差距。
随着《医用同位素中长期发展规划(2021-2035年)》、《国家药监局关于改革完善放射性药品审批审批管理的意见-征求意见稿》等一系列政策的出台,放药技术研发和监管体系日趋完善,在不久的将来越来越多放药获批上市,共同助力健康中国实现。