今年来,我国医药产业发展迅速,基本满足了人民群众用药需求,与此同时,公众对创新药的需求与日俱增,对仿制药质量也提出了更高要求。仿制药质量和疗效一致性评价将促进仿制药的质量提升,为实现仿制药与原研药同质同效、互相替代提供了重要标准和依据。
什么是仿制药质量和疗效一致性评价?推动一致性评价有何意义?当前进展如何?下面,一致性评价公司桐晖药业小编就给大家谈谈这些问题。
一致性评价相关概念
仿制药:是指与被仿制药具有相同的活性成分、剂量、规格剂型、质量、安全性、给药途径和治疗作用的药品。
范围:国外上市(新3类)、国内上市(新4类)
参比制剂:是指用于仿制药质量一致性评价的对照药品,可为原研药品或国际公认的同种药物。
原研药品:是指已经过全面的药学、药理学和毒理学研究,且具有完整和充分的安全性、有效性数据作为上市依据、拥有或曾经拥有相关专利、或获得了专利授权、在境外或境内首先批准上市的药品。
国际公认药品:是指与原研药品质量和疗效一致的药品。
生物利用度(Bioavailability,F):是指药物活性成分从制剂释放吸收进入全身循环的程度和速度。
高变异性药物(Highly variable drug):当某一药物的个体内变异系数(以AUC或Cmax计算的个体内变异系数)大于或等于30%时,称之为高变异药物。这种变异的增加使得对样本例数可能要求增加。
生物等效性(Bioequivalency , BE ):是指一种药物的不同制剂在相同的实验条件下,给予相同剂量,其活性成分吸收程度和速度的差异无统计学意义。
一致性评价的目的和意义
通过仿制药质量一致性评价,淘汰产品质量和临床疗效达不到原研制剂同等水平的仿制药,促进我国仿制药整体水平提升,达到或接近国际先进水平。
目前我国99%的药物是仿制药!绝大多数药物都没有和原研制剂进行过一致性评价!
国家层面的推动政策
没有按照一致性评价原则审批的所有仿制药,均需重新评价。
首先进行2007年10月1日前批准的国家基本药物目录(2012年版)中化药仿制口服固体制剂——2018年底之前完成一致性评价,否则注销文号。
其他仿制药在首家通过一致性评价后3年内不通过评价的,注销文号。
同一品种3家以上通过一致性评价,招投标中不予考虑未通过的。
通过质量一致性评价的仿制药允许其在说明书和标签上予以标注,在临床应用、招标采购、医保报销等方卖弄给予支持。
可申报该品种的上市许可持有人,委托其他企业生产;
发改委,工业及信息化部对企业的技术改造给予支持。
评价流程和一些困惑
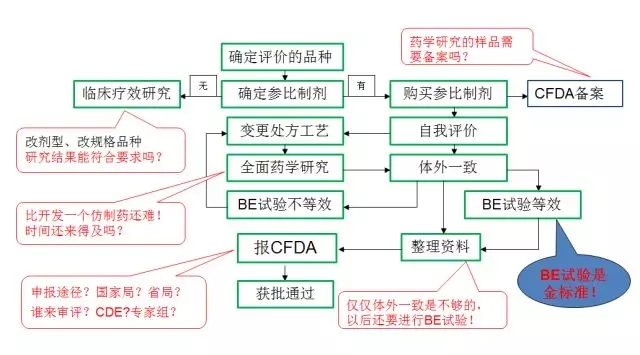
备案流程
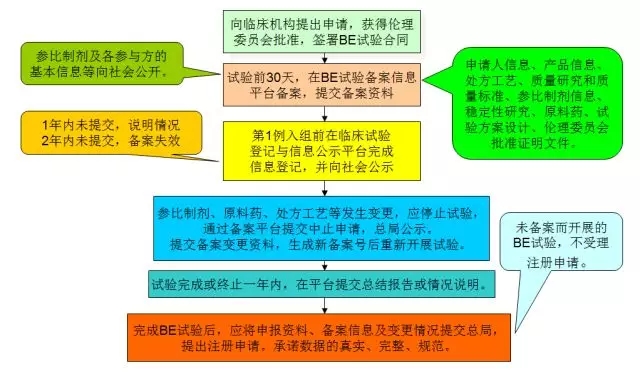
2018年底的大限----2007年10月1日前批准的国家基本药物目录。
首家通过后3年内----其他仿制药不通过评价的,注销文号。
同一品种3家以上通过----招投标中不予考虑未通过的。
药品文号和招投标是企业的生命,谁会不要命呢?
选择重点品种优先开展
质量、速度、真实性
留足变更工艺、做BE、补充申请、审评排队的时间
各方职责
药企主体责任:
按公布的目录确定待评价品种
鼓励目录外品种的评价
选择参比制剂,开展研究
按期完成,递交资料
配合药监局部门的检查、检验
按核准的处方工艺生产
CFDA总体组织协调:
建立工作机构、制定规划、发布信息
组建专家委员会、加强技术指导
建立激励与反激励机制,多管齐下
加强目标管理,淘汰落后
省局:
对辖区内企业进行激励指导
加强监督检查力度
通过评价后的监督抽验
一致性评价的研究方法
体内评价
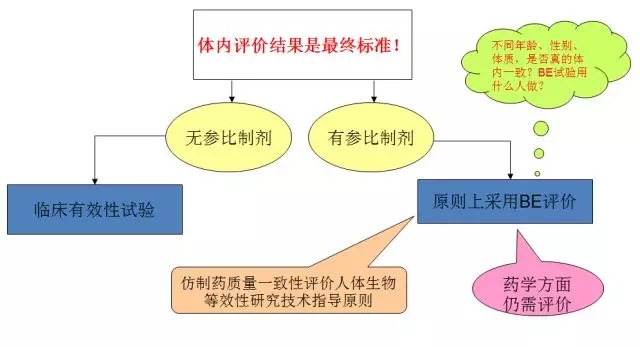
一致性评价的研究方法
体外评价
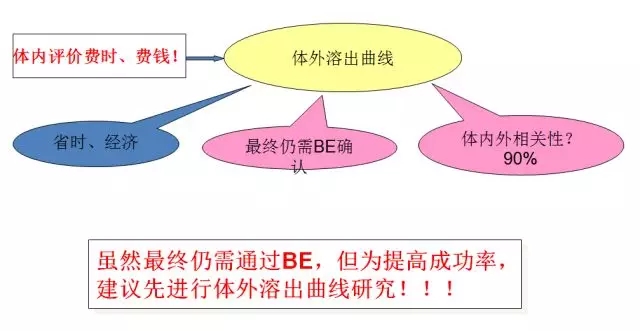
一致性评价,不局限于口服固体制剂!
全面的对比研究,不局限于溶出曲线或BE!
一致性评价,不仅是检测,还要有方法学研究!
其他关键药学指标,如晶型、粒径、异构体、含量、含量均匀度、有关物质、稳定性、包装等。
常规注射剂无需BE,全面比较药学一致性,有关物质、无机杂质、不溶性微粒、稳定性、渗压、PH值、包装等
包材相容性实验
一致性评价的研究方法
参比制剂的选择
首选原研,亦可选国际公认的同种药物,其质量及均一性应满足评价要求;
企业自选的,需报总局备案;总局在规定时限内(20工作日)未提出异议的,企业可开展研究工作;
行业协会可组织同品种企业提出意见,报总局审核发布;总局发布的,原则上均应选择其为参比制剂;
企业自行购买国外原研品,经总局批准一次性进口,供一致性评价研究用,其批次及数量应充分考虑到自评、省所复核、BE的要求。
BE试验研究总体设计
一般药物
两制剂、两顺序、两周期、单次、交叉试验设计;
随机顺序服用受试制剂和参比制剂。
半衰期较长药物(大于24小时)
单次、平行试验设计;
每个制剂分别在具有相似人口学特征的两组受试者中进行。
部分高变异药物体内变异≥30%
重复设计;
前两种的备选方案将同一制剂重复给予同一受试者,优势在于以较少数量的受试者进行试验。
高变异药物,可根据参比制剂的个体内变异,将评价标准作适当比例的调整
BE试验受试者选择
1)年龄在18周岁以上(含18周岁);
2)应涵盖一般人群的特征,包括年龄、性别等;
3)如果药物拟用于两种性别,一般情况下,研究入选的单一性别受试者例数不低于总例数的1/3;
4)如果药物主要适用于老年人群,应尽可能多地入选老年受试者(60岁及以上的人);
5)入选受试者的例数应满足生物等效性评价具有足够的统计学效力的要求,但并不要求所划分的亚组也满足统计学要求(一般不鼓励划分亚组进行统计分析)。
筛选受试者时的排除标准应主要基于安全性方面的考虑。当入选健康受试者参与试验可能面临安全性方面的风险时,可入选试验药物拟适用的患者人群,并且在试验期间应保证患者病情稳定。
BE试验给药方法
单次给药研究----通常推荐 !
稳态研究----有时出于安全性考虑,需入选正在进行药物治疗,且治疗不可间断的患者时,可在多次给药达稳态后进行等效性研究。
BE试验餐后生物等效性研究
为考察食物的影响,有时需要进行餐后生物等效性研究 !
对于口服常释制剂,通常需进行空腹和餐后生物等效性试验。但是当参比制剂说明书中明确说明该药物仅可空腹服用(饭前1小时或饭后2小时服用)时,则可不进行餐后试验。
对于仅能与食物同服的口服常释制剂,除了空腹服用可能有严重安全性方面风险的情况外,均建议进行空腹和餐后两种条件下的生物等效性试验。如有资料充分说明空腹服药可能有严重安全性风险,则仅需进行餐后生物等效性试验。
对于口服调释制剂,建议进行空腹和餐后生物等效性试验。
BE试验评价参数
1.吸收速度----Cmax,Tmax
2.吸收程度/总暴露量
单次给药研究,AUC0-t,AUC0-∞
多次给药稳态研究,AUC0-τ
3.部分暴露量(文章来源:简优医药)
以上就是一致性评价公司-桐晖药业小编分享的有关“一致性评价”的全部内容,供大家参考!
广州市桐晖药业有限公司是一家符合现代化管理要求的CRO公司,在进口原料药细分领域是为业界翘楚,为客户提供专业的药学研发、临床预BE、临床试验等临床评价服务,实现药学到临床一站式服务解决方案。目前的重点业务主要包括:原料药联合申报、参比制剂一次性进口、临床预BE/正式BE和一致性评价服务。如需合作,欢迎来电咨询!