2017年11月23日国家局发布第146号文《关于调整原料药、药用辅料和药包材审评审批事项的公告》,原辅包关联审评。根据国家药监局公告,已经不再单独受理原料药进口申请。那么在关联审评下如何变更境外的原料药供应商呢?
原料药一次性进口服务公司-桐晖药业小编为您整理了相关规定和指导原则,用一张图让您读懂如何变更原料药供应商。
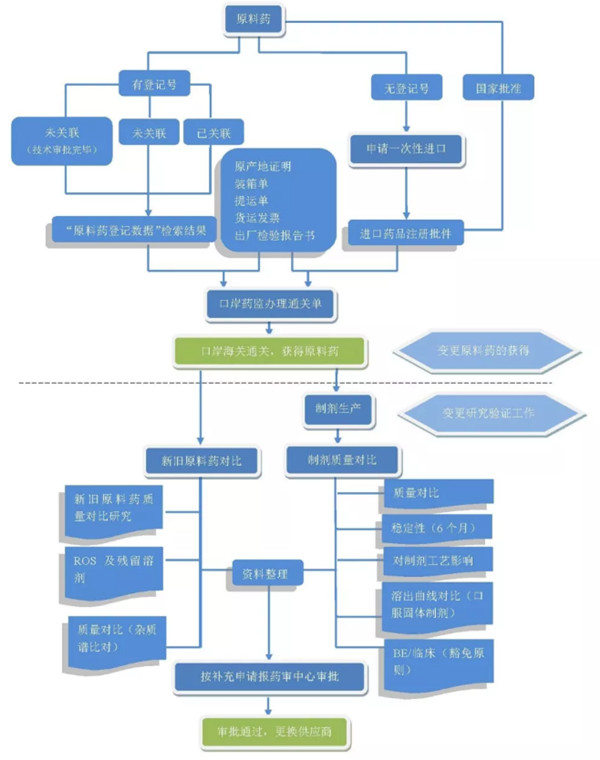
参考:总局关于调整原料药、药用辅料和药包材审评审批事项的公告(2017年第146号)
公告中第十条后半款:药品制剂申请人应当对选用原料药、药用辅料和药包材的质量负责,充分研究和评估原料药、药用辅料和药包材变更对其产品质量的影响,按照国家食品药品监督管理总局有关规定和相关指导原则进行研究,按要求提出变更申请或者进行备案。
参考:总局发布的《药品注册管理办法(修订稿)》征求意见稿第一百四十条的要求,原料药供应商的变更未来应属于国家局受理审批的补充申请。
参考:《已上市化学药品变更研究的技术指导原则(一)》。
参考:国家药品监督管理局关于药用原辅料进口通关有关事宜的公告(2018年第8号)。
以上就是一致性评价机构-桐晖药业小编分享的有关“一图读懂如何变更原料药供应商”的全部内容,供大家参考!
广州市桐晖药业有限公司是一家符合现代化管理要求的CRO公司,在进口原料药细分领域是为业界翘楚,为客户提供专业的药学研发、临床预BE、临床试验等临床评价服务,实现药学到临床一站式服务解决方案。目前的重点业务主要包括:原料药联合申报、参比制剂一次性进口、临床预BE/正式BE和一致性评价服务。如需合作,欢迎来电咨询!