7月3日,2018 恰好过去一半。Insight 数据库对目前申报一致评价的 232 个受理号中 55 个 CDE 发补的数据进行研究,发现:
1. CDE 发补,真的是通过一致性评价的信号
目前通过一致性评价的 4 批名单中,除第一批名单的 17 个受理号未经过发补直接通过外,之后的三个批次通过的受理号无一例外都是发补后再通过,即下面这个状态。
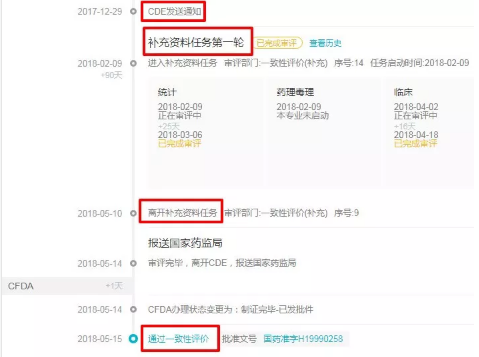
所以 CDE 发补后,99% 的可能是通过,另外的百分之一留给意外。
2. 现在还没申报的,年底很难完成一致性评价
对通过一致性评价的 45 个受理号逐一分析发现,第一批通过的品种平均需要 141 天,之后的三个批次从 CDE 承办到通过一致性评价平均需要 217 天,最短的是 125,最多需要 304 天。
如果都按照平均值 217 天,即 7.2 个月来算,现在还没开始申报的受理号基本都不能在年底通过一致性评价。
我们认为现在一致性评价的审评主要流程为
企业申请→CFDA 受理→CDE 承办→进入新报任务→开始新报任务审评→离开新报任务→CDE 发补→进入补充任务→开始补充任务审评→离开补充任务→CFDA 公布通过名单
我们以嘉林药业的阿托伐他汀为例图示上述流程:
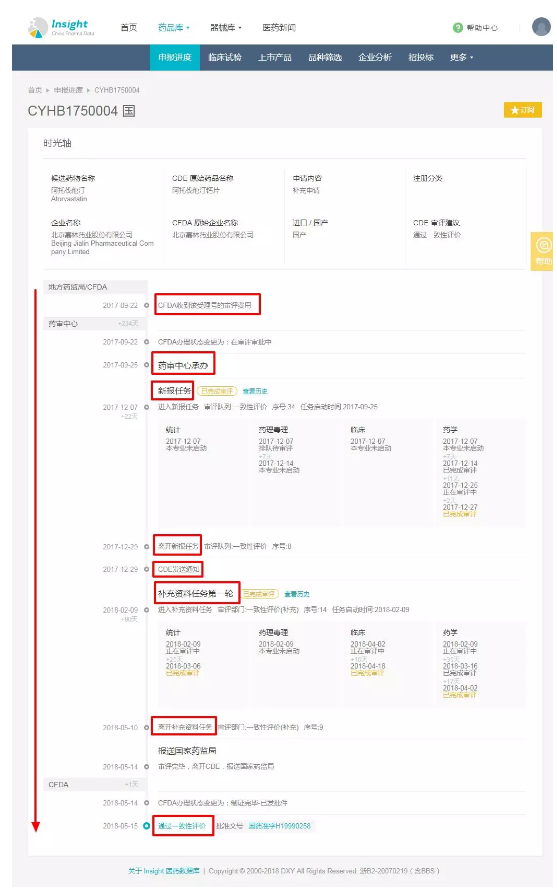
3.承办到进入新报任务的时间已减至 0 天
得益于一致性评价新报任务序列,2018 年之后,一致评价补充申请受理号从 CDE 承办到进入新报任务的时间越来越短,基本当日就能进入新报任务序列,在当天或者隔天开始审评。
4.新报任务审评平均时间为 61 天
从目前发补的 55 个受理号的审评情况来看,一个受理号从进入到离开新报任务平均需要 61 天,最少需要 21 天,最多需要的 116 天。
5.企业补充一轮资料平均需要 45 天,4 个月内不提交补充资料也可以继续提交
一个受理号从 CDE 发补到再次进入补充任务平均需要 45 天,最少需要 7,最多需要 151 天。
一致性评价公告曾提到:
审评工作一般应当在受理后 120 日内完成。经审评认为需申请人补充资料的,申请人应在 4 个月内一次性完成补充资料。发补时限不计入审评时限。
但实际上,也存在未在 4 个月内提交补充资料的受理号。如国药致君的头孢克肟颗粒(从 CDE 发补到再次进入补充任务花了 151 天),目前仍在补充任务审评中,暂未通过一致性评价。
6.补充任务审评时间需要 68 天
一个受理号从进入补充任务到离开补充任务再次平均需要 68 天,最少的 4 天,最多的 116 天。
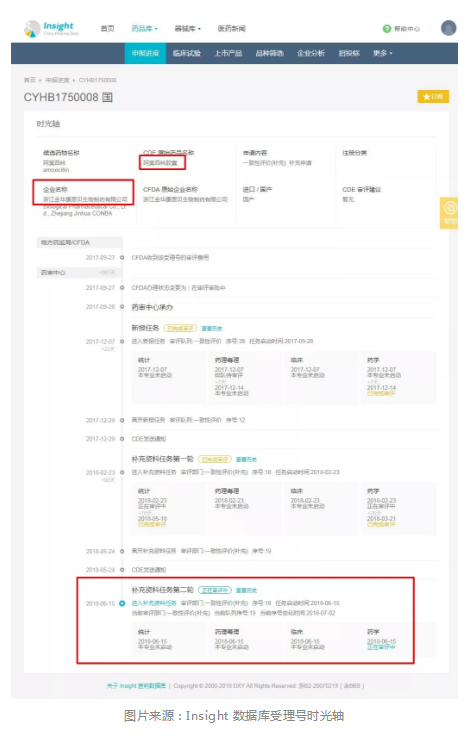
7.可能存在两次发补
以往我们的经验是,一个受理号只存在一轮发补,但康恩贝药业的阿奇霉素目前正在经历第二轮发补。
以上就是一致性评价机构-桐晖药业小编分享的来自Insight 数据库有关“一致性评价,知道这 7 个规律,你就成功了一半”的全部内容,供大家参考!
广州市桐晖药业有限公司是一家符合现代化管理要求的GSP公司,在进口原料药细分领域是为业界翘楚,为客户提供专业的从药学研发、临床预BE到临床BE的药厂研发一站式解决方案。目前的重点业务主要包括:原料药联合申报、参比制剂一次性进口、临床预BE/正式BE和一致性评价服务。如需合作,欢迎来电咨询!