今天,进口药注册代理-桐晖药业小编要给大家介绍下进口药品通关单备案办理指南及应注意的常见问题,希望能够对大家有所帮助!
一、获取进口药品通关单备案的条件:
申报本部门审批前需要到其他部门办理的审批
1:取得工商部门营业执照。
获得本部门审批的必要条件
应
1:取得国家食品药品监管局核发的《进口药品注册证》(或者医药产品注册证),或者《进口药品批件》(或者进口药材批件),进口麻醉药品、精神药品还需取得国家食品药品监管局核发的麻醉药品、精神药品《进口许可证》;
2:进口的药品属于《进口药品目录》(或者《麻醉药品管制品种目录》、《精神药品管制品种目录》)(见附录C)所列的药品,且不属于国家食品药品监督管理局规定的生物制品、首次在中国境内销售的药品和国务院规定的其他药品;
3:申请人(报验单位)应当是持有《药品经营许可证》的独立法人;药品生产企业进口本企业所需原料药和制剂中间体(包括境内分包装用制剂),应当持有《药品生产许可证》;进口药材申请人,应当是中国境内取得《药品生产许可证》或者《药品经营许可证》的药品生产企业或者药品经营企业;
4:进口药品到岸地应当在宁波北仑港;
5:《进口药品注册证》(或者医药产品注册证),或者《进口药品批件》(或者进口药材批件),或者麻醉药品、精神药品的《进口准许证》未超过有效期;
6:进口备案时,药品的有效期限应当不低于12个月,对于药品本身有效期不足12个月的,其有效期限应当不低于6个月。
不应
1:原产地证明所标示的实际生产地与《进口药品注册证》(或者《医药产品注册证》)规定的产地不符,或者区域性国际组织出具的原产地证明未标明《进口药品注册证》(或者《医药产品注册证》)规定产地;
2:到岸品种的包装、标签与国家食品药品监督管理局的规定不符;药品制剂无中文说明书或者中文说明书与批准的说明书不一致;
3:伪造、变造有关文件和票据,或者《进口药品注册证》(或者《医药产品注册证》)已被撤销;
4:申请人因隐瞒有关情况或者提供虚假材料申请进口药品通关单,而被处以一年内不得再次申请该行政许可的行政处罚,且该行政处罚未满一年的;
5:申请人因以欺骗、贿赂等不正当手段取得进口药品通关单,而被处以三年内不得再次申请该行政许可的行政处罚,且该行政处罚未满三年的。
获取进口药品通关单备案的程序及相关工作
申请和受理
申请人应把下列申请资料(文件、物品)送交市行政服务中心市场监管局窗口:
1:《进口药品报验单》(或《进口药材报验单》)(填写示例见附录B);
2:《进口药品注册证》(或者《医药产品注册证》),或者《进口药品批件》(或者进口药材批件)(正本或者副本)复印件;麻醉药品、精神药品的《进口准许证》复印件;
3:报验单位的《药品经营许可证》和《企业法人营业执照》复印件;药品生产企业自行进口本企业生产所需原料药和制剂中间体的进口备案,应当提交其《药品生产许可证》和《企业法人营业执照》复印件;
4:原产地证明复印件;
5:购货合同复印件;装箱单、提运单和货运发票复印件;经其他国家或者地区转口的进口药品,需要同时提交从原产地到各转口地的全部购货合同、装箱单、提运单和货运发票等。
6:出厂检验报告书复印件;
7:药品说明书及包装、标签的式样(原料药和制剂中间体除外);
8:最近一次《进口药品检验报告书》和《进口药品通关单》复印件。
窗口应对申请资料进行审查,核对申请资料是否齐全完整、符合法定形式
1:申请事项依法不属于本部门职权范围的,应当即时作出不予受理的决定,出具加盖本部门专用印章并注明日期的《不予受理通知书》,并告知申请人向有关行政机关申请;
2:申请材料存在可以当场更正的错误的,应当允许申请人当场更正;
3:申请材料不齐全或者不符合形式审查要求的,应当当场发给申请人《补正材料通知书》,一次性告知申请人需要补正的全部内容;
4:申请材料齐全、符合形式审查要求的,或者申请人按照要求提交全部补正申请材料的,予以受理,并直接进入审查程序。
回应时间:即办
审 查
申请人应:
审批部门应:
1:逐项核查所报资料是否完整、真实;
2:查验《进口药品注册证》(或者《医药产品注册证》),或者《进口药品批件》(或者进口药材批件)(正本或者副本)原件,或者麻醉药品、精神药品的《进口准许证》原件真实性;
3:审查无误后,将《进口药品注册证》(或者《医药产品注册证》)(正本或者副本)原件,或者麻醉药品、精神药品的《进口准许证》原件,交还报验单位,并于当日办结进口备案的相关手续。
回应时间:即办
决 定
1:窗口审查全部资料无误后,准予进口备案,发出《进口药品通关单》,收回一次性有效批件;同时向负责检验的浙江省药品检验所发出《进口药品口岸检验通知书》(或者《进口药材口岸检验通知书》),附申请人申报的登记备案资料一份;
2:对麻醉药品、精神药品,窗口审查全部资料无误后,只向负责检验的浙江省药品检验所发出《进口药品口岸检验通知书》,附申请人申报的登记备案资料一份,无需办理《进口药品通关单》;
3:窗口经审查不符合要求的,不予进口备案,发出《药品不予进口备案通知书》(或者《进口药材不予登记备案通知书》),并说明理由,告知救济途径;
4:对麻醉药品、精神药品,窗口经审查不符合要求的,不予发放《进口药品口岸检验通知书》,并说明理由,告知救济途径。
回应时间:即办
流程图:
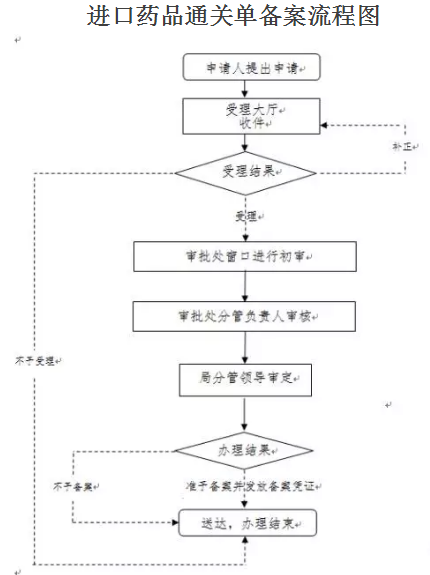
重要提示:
1:《进口药品通关单》仅限在该单上注明的口岸海关使用,并实行一批一证制度,证面内容不得更改,如需更改,须换发新证;进口单位凭《进口药品通关单》向海关办理报关验放手续。
2:按照国家药品生产经营的有关管理规定,由中国境内报关出口的,因残损、短少、品质不良或者规格不符等原因,原状退货复运进境的药品,不在此《办法》管理范围之内。
3:药品生产企业凡生产2012年版《国家基本药物目录》药品品种,无论是否参与基本药物招标采购,均应按规定实施电子监管。国产药品和在国内分包装的进口药品应于2013年11月底前实行电子监管,进口药品应于2014年3月底前实行电子监管。
四、申办过程中应注意的常见问题
1:申请人报送所进口品种的有关资料一式两份,提交复印件的,应当加盖进口单位公章,并出示原件供审核;
2:申请材料中同一项目的填写应一致;申请材料应使用A4规格纸张打印,政府及其他机构出具的文件按原件尺寸提供;申请材料应清晰、整洁,每份申请材料均应加盖企业公章,并按照申请材料目录的顺序装订成册;
3:展览药品(在展览会、技术交流会或类似活动中展示或演示用的药品)属海关同意的暂时进口货物,进口时不需办理药品进口备案手续和口岸检验;
4:进口蛋白同化制剂、肽类激素,进口单位凭国家食品药品监督管理局核发的药品《进口准许证》直接向允许药品进口的口岸海关申报,海关凭药品《进口准许证》验放,无需办理《进口药品通关单》;
5:国家食品药品监督管理局规定的生物制品、首次在中国境内销售的药品和国务院规定的其他药品,其到岸地必须为北京市、上海市和广州市3个口岸城市的指定通关口岸;
6:凡列入《非药用物品目录》中的物品,进口单位可凭营业执照复印件、装箱单、提运单等资料,直接到口岸药品监督管理局办理《进口药品通关单》。口岸药品监督管理局应在《进口药品通关单》中注明“非药用,不需进行药品口岸检验”;
7:进口临床急需药品、捐赠药品、新药研究和药品注册所需样品或者对照药品,以及检验用对照品、标准品,应凭国家食品药品监督管理局批准的《进口药品批件》向口岸药品监督管理局申请办理《进口药品通关单》。
以上就是进口药注册代理公司-桐晖药业小编分享的有关“进口药品通关单备案办理指南及应注意的常见问题”的全部内容,供大家参考!
广州市桐晖药业有限公司是一家符合现代化管理要求的CRO公司,在进口原料药细分领域是为业界翘楚,为客户提供专业的药学研发、临床预BE、临床试验等临床评价服务,实现药学到临床一站式服务解决方案。目前的重点业务主要包括:原料药联合申报、参比制剂一次性进口、临床预BE/正式BE和一致性评价服务。如需合作,欢迎来电咨询!