为了持续推进仿制药开发,FDA开展了一系列工作,包括发布推荐仿制药开发名单,发布《ANDA 提交质量管理规范》行业指南草案和《ANDA 评估质量管理规范》政策程序手册(MAPP),用于引导仿制药行业有序健康发展。7月20日,FDA又发布新一批仿制药BE指导方案,为仿制药企业提供产品研发指南。
为了成功开发和生产仿制药产品,申请人应考虑其产品应符合药学上与其参比制剂(RLD)等效,即在相同使用条件下具有相同的活性成分、剂型、规格和给药途径。生物等效于RLD,即,显示活性药物成分的吸收速率和程度没有显著差异;后续的治疗等效,即可替代RLD,期望仿制药具有与其参比制剂相同的安全性和有效性。
根据21 CFR 320.24,可以使用不同类型的证据来确定药学等效制剂的生物等效性,包括体内或体外测试。用于证明生物等效性的方法的选择取决于研究目的、可用的分析方法和制剂的性质。根据该规定,申请人必须使用21 CFR 320.24中规定的最准确,最敏感和可重复的方法进行生物等效性测试。作为选择仿制药制剂研发方法的第一步,申请人可参考以下指南草案:根据简化新药申请(ANDA)提交的药物药代动力学终点的生物等效性研究工业指南草案(2013年12月)。
为了进一步促进仿制药制剂的供应,并协助仿制药行业确定最合适的药物开发方法,并产生支持ANDA批准所需的证据,FDA发布仿制药BE指导方案,描述了监管机构目前对如何开发治疗上与特定参比制剂相当的仿制药制剂的想法和期望。
FDA发布仿制药BE指导方案,以促进药品开发、ANDA提交和批准,最终提供更多的安全和可负担的仿制药。
这些指导方案以递增方式发布,并根据活性成分的名称按字母顺序列出如下。下面列出了最近发布的指导方案(新的和修订的)。
此外,作为FDA根据2017年仿制药使用者费用修正重新授权(GDUFA II)法案承诺的一部分,FDA将发布(1)新化学实体和(2)在2017年10月1日或之后批准(最早的合法ANDA申请日期之前至少2年)的参比制剂指南。该目标不包括GDUFA II承诺书中定义的复杂制剂。一旦获得科学建议,FDA将努力为复杂制剂发布指导。
除了所提供的信息,赞助商和研究者的任何IND豁免药代动力学(PK)研究,药效学(PD)研究,或涉及人类受试者的支持ANDA的生物等效性(BE)和/或生物利用度(BA)研究应参考当前的RLD标签,包括黑框警告、禁忌令、警告和注意事项以及不良反应部分。在研究设计和实施过程中应考虑这些信息;包括注意适当的受试者筛选和选择,纳入和排除标准,以及适当的临床安全监测。
活性药物成分研发BE指导方案
2018年7月20日发布的新增指导方案(26个新增)
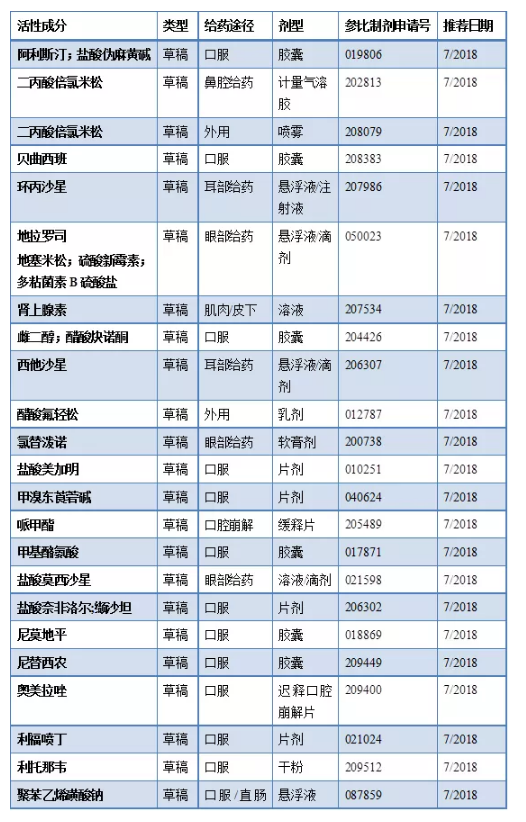
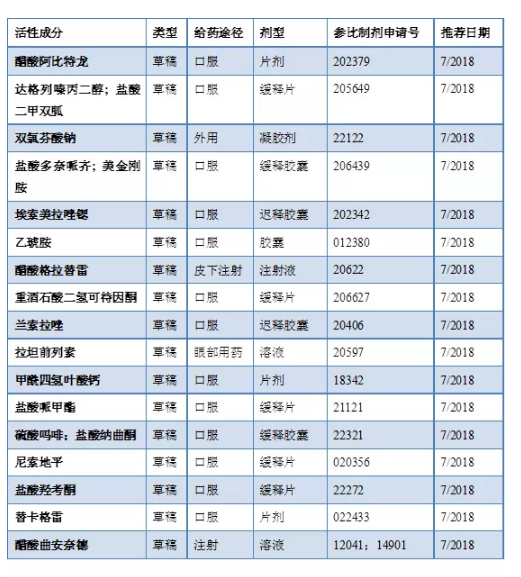
2018年7月20日发布的修订指导方案(17个修订)
以上就是广州临床研究机构-桐晖药业小编分享的有关“FDA发布新一批仿制药BE指导方案”的全部内容,供大家参考!
广州市桐晖药业有限公司是一家符合现代化管理要求的GSP公司,在进口原料药细分领域是为业界翘楚,为客户提供专业的从药学研发、临床预BE到临床BE的药厂研发一站式解决方案。目前的重点业务主要包括:原料药联合申报、参比制剂一次性进口、临床预BE/正式BE和一致性评价服务。如需合作,欢迎来电咨询!