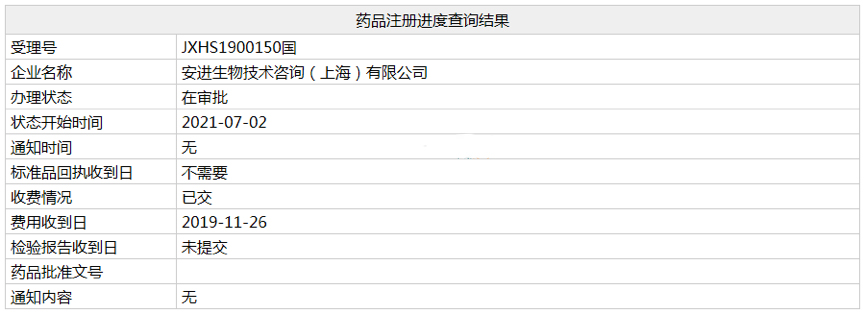
近日,安进多发性骨髓瘤药物「注射用卡非佐米」的上市申请(相关受理号为JXHS1900150)在NMPA的状态变更为“在审批”,预计不日将正式获批。
卡非佐米(carfilzomib,Kyprolis)是一款蛋白酶体抑制剂。蛋白酶体可以分解受损或不再需要的蛋白,对细胞的正常功能和生长都有重要的作用。研究发现,多发性骨髓瘤细胞会产生大量异常蛋白,抑制蛋白酶体会让其不堪重负而崩溃、死亡。
Carfilzomib由Proteolix 开发,后被Onyx Pharmaceuticals收购,2013年安进斥资104亿美元收购Onyx
Pharmaceuticals时获得该药。自2012年7月被FDA加速批准上市后,Kyprolis已经获批多项适应症,包括:
(1)单药用于先前已接受过至少2种药物治疗但复发(包括Velcade和Thalomid)的MM患者;
(2)联合Revlimid(lenalidomide,来那度胺)及地塞米松(dexamethasone)(即KRd组合)用于既往已接受1-3线治疗的复发性MM患者;
(3)联合Darzalex(daratumumab,达雷妥尤单抗)和地塞米松用于先前已接受过1-3种疗法的R/R MM成人患者。
而且,2018年10月FDA还批准了Kyprolis每周一次的新方案,即每周一次70mg/m2剂量Kyprolis联合地塞米松用于治疗R/R
MM。此外,Kyprolis联合Darzalex和地塞米松(即(DKd)方案)治疗R/R MM的补充新药申请目前美国接受审查。
据安进财报,Kyprolis上市后销售额逐年攀升,2019年突破10亿美元成为重磅产品。不过2020年该药的销售额增长明显变缓,不知是否是受新冠疫情的影响。
在国内,Kyprolis的上市申请于2019年11月被CDE受理,如今该上市申请进入行政审批阶段,预计很快将正式获批。值得一提的是,2019年11月,安进与百济神州达成战略合作,授予百济神州在中国开发和商业化Xgeva(地舒单抗)、Kyprolis(卡非佐米)和Blincyto(倍林妥莫双抗)权利,其中地舒单抗和倍林妥莫双抗均已在国内正式获批。据相关数据统计,目前国内已有企业开始布局卡非佐米仿制药市场,大多已被批准临床,泰格医药进展较快,处于III期临床阶段。
卡非佐米原研为Amgen,2012年7月获得FDA批准上市,和硼替佐米同属于蛋白酶体抑制剂(PI),用于复发/难治性多发性骨髓瘤(MM)的治疗。相比于硼替佐米,卡非佐米具有更强的蛋白酶体抑制活力,更少的脱靶效应。作为新一代的高度选择性不可逆蛋白酶体阻断药,
多个临床研究证实卡非佐米单药或与其他药物联合治疗具有较强的抗 MM
作用,毒性作用小,尤其外周神经病变发生率较低,患者耐受性好,安全性高,临床可长期使用。业界预计其可能会取代硼替佐米,市场前景看好。
目前,卡非佐米化合物专利2025年到期,国内尚未上市,无进口及国产原料批文,桐晖药业可提供进口原料,用于研发生产,质优资质全。

桐晖原料药卡非佐米的相关供应信息
| 产品名 | 卡非佐米/Carfilzomib |
| CAS | 868540-17-4 |
| 申报家数 | 制剂0家原料2国1进 |
| 原料来源 | 印度 |
| CDE备案状态 | 准备注册 |
| USDMF状态 | 已有USDMF,已激活 |
| 可申报剂型 | 注射液 |
| 专利 | 化合物专利2025年到期 |
| 国内市场情况 | 国内尚未上市,无进口及国产原料批文,可提供进口原料,质量优资质全。 |
| 项目支持 | 支持联合申报 |